Перевага брентуксимабу ведотину у лікуванні хворих на CD30+ периферичну Т-клітинну лімфому
Результати дослідження ECHELON-2
Неходжкінська лімфома (НХЛ) є найпоширенішим у світі злоякісним гематологічним захворюванням і становить близько 3% усіх діагнозів раку та спричинених ним випадків смерті. НХЛ посідає сьоме місце за поширеністю серед онкологічних захворювань і шосте місце за рівнем смертності від них. НХЛ частіше розвивається у чоловіків віком понад 65 років та осіб з аутоімунними захворюваннями або обтяженим щодо онкогематологічних захворювань сімейним анамнезом. Згідно з останньою класифікацією НХЛ Всесвітньої організації охорони здоров’я (ВООЗ), розрізняють понад 40 підваріантів НХЛ. Найпоширенішими є індолентна фолікулярна лімфома (22%) та дифузна В-великоклітинна лімфома (31%).
Периферична Т-клітинна лімфома – це гетерогенна група агресивних НХЛ, які розвиваються зі зрілих клітин – Т-лімфоцитів і природних клітин-кілерів. Найпоширенішими периферичними
Патогномічною ознакою системної анапластичної великоклітинної лімфоми є експресія CD30. Антиген CD30 – трансмембранний глікопротеїн, що належить до надсімейства рецепторів фактора некрозу пухлини. Стимуляція CD30 справляє плейотропні ефекти на ріст і виживання клітин, які значною мірою залежать від активації шляху NF-κB (R. Chiarle et al., 1999; S.L. Buchan et al., 2012). Однак при несистемних підваріантах анапластичних великоклітинних лімфом експресія CD30 є варіативною і становить приблизно 58-64% при периферичній Т-клітинній лімфомі некласифікованій, 43-63% – при ангіоімунобластній Т-клітинній лімфомі, 55% при Т-клітинному лейкозі або лімфомі дорослих та 0-100% при Т-клітинній лімфомі, асоційованій з ентеропатією (C. Bossard et al., 2014; E. Sabattini et al., 2013). CD30 є привабливою терапевтичною мішенню у лікуванні лімфопроліферативних захворювань, які характеризуються високою експресією цього антигену.
Брентуксимабу ведотин – кон’югат антитіл з лікарським засобом, який доставляє антинеопластичний агент до CD30-позитивних пухлинних клітин, що призводить до їх апоптотичної загибелі. Управління з контролю якості харчових продуктів і лікарських препаратів США схвалило кілька показань для застосування цього лікарського засобу, зокрема системна анапластична великоклітинна лімфома та попередньо не лікована периферична Т-клітинна лімфома з експресією CD30 у дорослих пацієнтів. У ході клінічних досліджень І фази брентуксимабу ведотин у комбінації зі схемою CHP (циклофосфамід + доксорубіцин + преднізолон) у пацієнтів з CD30+ периферичною Т-клітинною лімфомою продемонстрував обнадійливі результати щодо ефективності за прийнятного профілю безпеки. Так, у 100% хворих була відмічена об’єктивна відповідь (ОВ) на лікування, 92% – досягли повної ремісії (ПР). Після медіани спостереження 59,6 міс не було досягнуто медіани виживаності без прогресування (ВБП) та загальної виживаності (ЗВ). Через 35 міс не було зафіксовано випадків прогресування хвороби чи смерті. Розрахункова 5-річна ВБП та ЗВ склала 52 та 80% відповідно (M.A. Fanale et al., 2018). Отримані результати стали підґрунтям для проведення подвійного сліпого рандомізованого плацебо-контрольованого дослідження ІІІ фази з подвійною імітацією та активним контролем ECHELON-2, яке включило 132 центри у 17 країнах. Метою дослідження було порівняти ефективність і безпеку схеми з брентуксимабом ведотином (А+CHP) та схеми CHOP (S. Horwitz et al., 2018).
Дизайн дослідження ECHELON-2
У дослідження було включено пацієнтів старших 18 років з діагностованою CD30+ периферичною Т-клітинною лімфомою (відповідно до класифікації ВООЗ 2008 р.), які раніше не отримували лікування. 452 пацієнти було рандомізовано на дві групи – А+CHP (n=226) та CHOP (n=226). Пацієнти отримували лікування за 21-денними циклами. Кількість циклів (6 або 8) визначав дослідник на момент реєстрації.
Усі пацієнти отримували компоненти CHP зі схеми CHOP (циклофосфамід 750 мг/м2 площі поверхні тіла і доксорубіцин 50 мг/м2 внутрішньовенно в 1-й день кожного циклу та преднізон 100 мг 1 р/день перорально з 1-го по 5-й день кожного циклу). У групі A+CHP пацієнти отримували брентуксимабу ведотин (1,8 мг/кг маси тіла внутрішньовенно у 1-й день кожного циклу) та плацебо-форму вінкристину, у групі CHOP – вінкристин (1,4 мг/м2 (максимум 2,0 мг/м2) внутрішньовенно у 1-й день кожного циклу) та плацебо-форму брентуксимабу ведотину.
Первинною кінцевою точкою дослідження була ВБП за оцінкою засліпленого незалежного експертного комітету (BICR), яка визначалася як час від дати рандомізації до дати першого документального підтвердження рецидиву або прогресування захворювання, смерті внаслідок будь-якої причини чи призначення наступної системної хіміотерапії для лікування залишкової або прогресуючої периферичної Т-клітинної лімфоми. Вторинні кінцеві точки дослідження – ВБП за даними BICR для пацієнтів з підтвердженою системною анапластичною великоклітинною лімфомою, частота ПР за даними BICR після завершення лікування, ЗВ і частка пацієнтів, які досягли ОВ за даними BICR.
Результати дослідження ECHELON-2
Первинна кінцева точка
Після медіани спостереження 36,2 міс (95% довірчий інтервал – ДІ – 35,9-41,8) медіана ВБП у групах A+CHP та CHOP склала 48,2 міс (35,2 – не оцінюється) та 20,8 міс (12,7-47,6) відповідно (відношення ризиків – ВР – 0,71; 95% ДІ 0,54-0,93; p=0,0110). Трирічна ВБП у групі A+CHP склала 57,1% (49,9-63,7), у групі CHOP – 44,4% (37,6-50,9; рис. 1). Застосування схеми A+CHP на 29% знижує ризик подій, пов’язаних із ВБП, порівняно зі схемою CHOP.
 Рис. 1. ВБП у групах CHOP та A+CHP
Рис. 1. ВБП у групах CHOP та A+CHP
Вторинні кінцеві точки
Використання схеми лікування A+CHP знизило ризик смерті на 34% порівняно з CHOP (ВР 0,66; 95% ДІ 0,46-0,95; p=0,0244; рис. 2). Протягом дослідження було зафіксовано 124 випадки смерті: 51 (23%) випадок у групі A+CHP та 73 (32%) випадки у групі CHOP. Після медіани спостереження 42,1 міс (95% ДІ 40,4-43,8) медіана ЗВ не була досягнута у жодній групі. Була відмічена чисельна перевага показників ЗВ у ключових підгрупах пацієнтів: з гістологічними підтипами несистемної анапластичної великоклітинної лімфоми, периферичною Т-клітинною лімфомою неуточненою й ангіоімунобластною Т-клітинною лімфомою.
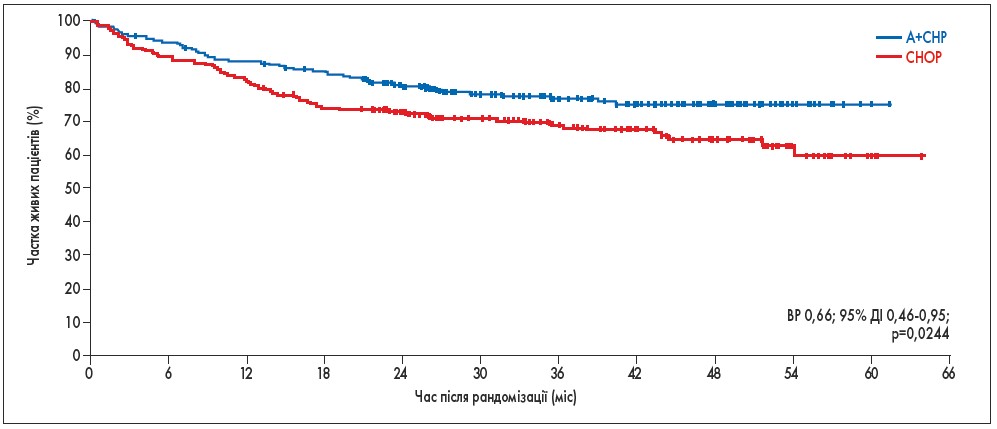
Рис. 2. Частка пацієнтів, які вижили, у групах CHOP та A+CHP
За даними BICR, у групі A+CHP ризик розвитку подій, пов’язаних із ВБП, знизився на 41% у пацієнтів із системною анапластичною великоклітинною лімфомою порівняно з CHOP (ВР 0,59; 95% ДІ 0,42-0,84; p=0,0031). Частота ПР і частка пацієнтів з ОВ були значно вищими у групі A+CHP, ніж у групі CHOP (частота ПР р=0,0066; ОВ р=0,0032). Подібні результати були отримані на підставі даних дослідників (частота ПР р=0,0043; ОВ р=0,0018).
За винятком трансплантації стовбурових клітин і променевої терапії з метою консолідації відповіді на початкову терапію 59 (26%) пацієнтів у групі A+CHP та 94 (42%) пацієнти у групі CHOP продовжували лікування з приводу залишкової хвороби або прогресування хвороби. Наступна лінія терапії містила брентуксимабу ведотин у 23 (10%) хворих у групі A+CHP та 49 (22%) у групі CHOP. Більшість пацієнтів завершили лікування згідно з призначенням, 198 (89%) учасників у групі A+CHP та 184 (81%) у групі CHOP отримали шість і більше циклів терапії.
Безпека
Частота виникнення та тяжкість небажаних явищ (НЯ), що виникли під час лікування, загалом були зіставними в обох групах. Що стосується НЯ 3 ступеня тяжкості і вище, то в обох групах показники також були зіставними. Через непереносимі НЯ терапію припинили 14 (6%) пацієнтів групи A+CHP та 15 (7%) пацієнтів групи CHOP. В обох групах також відмічалася зіставна частота й тяжкість нейтропенії. Слід зазначити, що у хворих, які отримували первинну профілактику гранулоцитарним колонієстимулюючим фактором, відмічалася менша частота й тяжкість нейтропенії. Фебрильну нейтропенію мали 41 (18%) пацієнт групи A+CHP та 33 (15%) пацієнти групи CHOP, у тому числі 1 – фебрильну нейтропенію 5 ступеня тяжкості у групі CHOP. Під час лікування периферична нейтропенія виявлена у 117 (52%) хворих групи A+CHP та 124 (55%) – групи CHOP. Тяжкість проявів периферичної нейропатії знизилася до початкового рівня або нижче у 58 (50%) пацієнтів у групі A+CHP (медіана часу до покращення стану дорівнювала 17,0 тижня) та у 79 (64%) пацієнтів у групі CHOP (медіана часу до покращення 11,4 тижня).
Висновки
ECHELON-2 – перше проспективне дослідження за участю пацієнтів з периферичною Т-клітинною лімфомою, яке показало загальну перевагу схеми з використанням брентуксимабу ведотину (A+CHP) над стандартною терапією CHOP. Перевага A+CHP була продемонстрована за первинними та вторинними кінцевими точками дослідження без підвищення токсичності. Отримані дані створюють передумови для того, щоб схема A+CHP стала новим стандартом лікування пацієнтів з CD30-позитивною периферичною Т-клітинною лімфомою, зокрема із системною анапластичною великоклітиною лімфомою.
За матеріалами S. Horwitz et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. 2018. http://dx.doi.org/10.1016/S0140-6736(18)32984-2.
Стаття підготовлена за підтримки ТОВ «Такеда Україна».
C-APROM/UA/ADC/0016
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (71) 2021 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...




