Ехокардіографія
Частина 1 Частина 2
Фізичні засади ультразвукової візуалізації серця
 Ехокардіографія ґрунтується на аналізі відбитих від структур серця ультразвукових хвиль, які випромінює датчик діагностичного ультрасонографічного апарату. Поверхня датчика генерує вібрації, які проводяться через тіло людини, як і через будь-яке інше середовище, у вигляді почергових стиснень і розріджень. Через м’які тканини тіла (м’язи, паренхіматозні органи, жирова клітковина) ультразвук проникає зі швидкістю приблизно 1500 м/с, тоді як через повітря – 300 м/с (Флакскампф, 2013).
Ехокардіографія ґрунтується на аналізі відбитих від структур серця ультразвукових хвиль, які випромінює датчик діагностичного ультрасонографічного апарату. Поверхня датчика генерує вібрації, які проводяться через тіло людини, як і через будь-яке інше середовище, у вигляді почергових стиснень і розріджень. Через м’які тканини тіла (м’язи, паренхіматозні органи, жирова клітковина) ультразвук проникає зі швидкістю приблизно 1500 м/с, тоді як через повітря – 300 м/с (Флакскампф, 2013).
Швидкість проникнення ультразвуку в середовищі пов’язана з довжиною хвилі (відстань між двома послідовними підйомами або спадами) і частотою хвилі:
Швидкість проникнення =
частота хвилі х довжина хвилі.
Відлуння ультразвукових променів, вловлене датчиком, дає змогу виконати реконструкцію скенованої поверхні в тому випадку, коли довжина хвилі не перевищує розмір часточки, від якої промінь відбивається. Якщо, для прикладу, через щільні тканини тіла пропустити промінь частотою 1000 Гц (1 Гц – один цикл за секунду), який проходить через них зі швидкістю приблизно 1500 м/с, то довжина хвилі такого променя становитиме 1,5 м. Така довжина хвилі не може бути використана для візуалізації серця, яке від основи до верхівки має приблизно 15 см. Необхідно, скенуючи серце, розрізняти структури товщиною хоча б 1 мм. Щоб хвиля мала довжину 1 мм, частота ультразвуку має становити 1500 000 Гц, або 1,5 МГц.
Чим більша частота хвилі ультразвукового променя, тим менші за розміром об’єкти вдається розпізнати під час скенування (Lancellotti and Cosyns, 2016).
Людське вухо здатне вловити ті коливання, частота яких міститься в межах від 30 до 20 000 Гц. Це так званий звуковий діапазон. Для скенування серця застосовують коливання з набагато вищою частотою, які називають ультразвуком.
Ультразвукова хвиля, яка поширюється через певне середовище, має багато таких самих властивостей, як і світло, тобто може бути сфокусована у промінь, який підпорядковується оптичним законам відбиття і заломлення. Ультразвуковий промінь, який проходить через тіло і досягає межі між двома середовищами з різними властивостями, такими, наприклад, як м’яз і кров, частково відбивається від поверхні, яка розділяє середовища.
Чим більше ці середовища відрізняються за своїми властивостями проводити ультразвукову хвилю, тим інтенсивніше відбивається промінь. Віддзеркалена ультразвукова хвиля (ехо-сигнал) повертається до датчика, повторюючи свій попередній шлях у зворотному напрямку, поступово розсіюючись і згасаючи. Тому датчик вловлює набагато слабший сигнал, ніж той, що був ним випромінений. Певні параметри цього відлуння можуть бути оцінені електронною частиною діагностичного апарату і використані для побудови зображення.
Ультразвуковий датчик (трансдюсер, перетворювач, щуп) складається з групи п’єзоелектричних кристалів, які деформуються під дією електричного струму, коливаються і генерують ультразвукові промені. Відбиті від скенованих структур ультразвукові промені повертаються назад до датчика, викликаючи коливання п’єзоелектричних кристалів, що, своєю чергою, створює на їх поверхні різницю потенціалів, яка у вигляді струму передається в апарат для подальшої обробки. Кожен кристал може як генерувати ультразвукові хвилі, так і приймати відображені в тканинах тіла ехо-сигнали (Флакскампф, 2013).
На поверхні сучасних датчиків для скенування серця зазвичай вмонтовано не менше 128 п’єзоелектричних кристалів, до кожного з яких підходять тоненькі дротики, і кожен з них окремо несе електричні імпульси. Поверхня датчика переважно має площу до 2 см2. Для обстеження серця і магістральних судин застосовують датчики, які генерують частоти в діапазоні 1,5‑7 МГц (Рисована та Радзішевська, 2016).
Ультразвукова хвиля, яка проходить через тіло, поступово згасає. Так, наприклад, хвиля із частотою 2 МГц втрачає половину своєї енергії, коли проходить відстань 15 см у крові, 5 см – у м’яких тканинах, 0,5 см – у кістці, 0,05 см – у легенях. Тому, щоб проводити ехокардіографію, треба ставити датчик у місцях, де ультразвуковий промінь може проникнути до серця, оминаючи ребра і легені. Такі місця називають «ультразвуковими вікнами». Крім того, застосовують спеціальний гель, який накладають між робочою поверхнею датчика і шкірою пацієнта, щоб поліпшити контакт між ними, забезпечити добре проведення ультразвукової хвилі й усунути часточки повітря, які особливо заважають отримати якісне зображення.
Швидкість поширення ультразвуку в м’яких тканинах досить постійна, тому діагностичний апарат розраховує глибину, з якої повернувся відображений промінь за часом, який необхідно, щоб промінь пройшов до точки, де він відбився від межі середовищ, і повернувся звідти назад до датчика. Цей проміжок називають часовою затримкою.
Часова затримка =
2 х Відстань від поверхні датчика до точки, звідки повернулося відлуння/ Швидкість поширення ультразвуку
Складні комп’ютери можуть аналізувати віддзеркалення від кількох структур одночасно і відображати їх на екрані діагностичного приладу в місцях, які відповідають глибинам, звідки повернувся кожен сигнал. Яскравість точки, де відбився ультразвуковий промінь, залежить від інтенсивності відображеного сигналу. Якщо ультразвуковий промінь електронним способом дуже швидко протягти через сектор скенування, то можна отримати двовимірне зображення.
Якщо таке секторальне скенування проводити достатньо швидко і так само швидко аналізувати відображені сигнали, то можна створити зображення, яке в реальному часі відображає рух серцевих структур (Otto, 2013).
Діагностичний апарат розраховує відстань до об’єкта, який створив відлуння, враховуючи середню швидкість поширення ультразвуку в м’яких тканинах (1540 м/с). Якщо ж на шляху променя трапиться об’єкт з інакшою швидкістю проведення ультразвуку, наприклад замикальний елемент клапанного протеза, то розраховані апаратом відстані будуть цілком неправильні, а зображення спотворене (Lancellotti and Cosyns, 2016).
Кілька характеристик ультразвуку відіграють важливу роль в отриманні високоякісних зображень. Скенування високочастотним променем забезпечує високу роздільну здатність: чим більша частота, тим менша довжина хвилі, а чим менша довжина хвилі, тим менший за розміром об’єкт можна розпізнати як окремий. Крім того, високочастотний промінь із проникненням у глибину дає менше бічних відгалужень і довше залишається вузьким (зберігає циліндричну форму і не стає конусоподібним).
А це, своєю чергою, забезпечує високу чіткість отриманого зображення на всій глибині скенування.
Однак високочастотний промінь значно сильніше відбивається і розсіюється, ніж низькочастотний промінь, а тому швидше згасає під час проходження через тканини організму. Коли проводять ехокардіографічне обстеження дитини, використовують датчик з високою частотою (менша проникність, зате вища роздільна здатність), а коли обстежують дорослого, то вмикають датчик із нижчою частотою (більша проникність, однак менша роздільна здатність).
Загальний принцип вибору частоти променя скенування такий: треба застосовувати якомога вищу частоту, яка ще дає можливість отримати сигнали з тієї глибини, де міститься об’єкт діагностичного зацікавлення (Otto, 2013).
Щоб створити зображення серця, через грудну клітку на серце посилають потік дуже коротких імпульсів ультразвукових хвиль, кожен із яких складається з кількох коливань і триває всього 1‑2 мікросекунди. Імпульс проникає через грудну стінку, проходить через перикард на серце, зустрічаючи на своєму шляху різні поверхні, що розмежовують тканини з різними властивостями проведення ультразвуку: міокард, кров, стулки клапанів, жирова клітковина тощо. Частина ультразвукової хвилі відбивається від цих поверхонь, а частина, уже з меншою енергією, проходить у глибші шари тканин. Повністю повертається назад до датчика, повторюючи той самий шлях, лише та ультразвукова хвиля, яка вдарилася об поверхню під кутом 90°.
Під час скенування серця досягти такого щодо всіх поверхонь неможливо, однак структури серця не є цілком гладенькими, що дає можливість отримати відлуння навіть тоді, коли скенована поверхня розміщена щодо ходу променя майже паралельно. Але в такому випадку енергія відбитого ультразвуку буде незначною, а на екрані ця точка буде позначена слабким сигналом. Саме тому цілком однакові структури серця, наприклад стулки аортального клапана, виглядатимуть на отриманому зображенні дещо по-різному, залежно від того, під яким кутом падав на них при скенуванні ультразвуковий промінь (Флакскампф, 2013).
Часовий проміжок, за який усі відбиті ехосигнали повертаються до датчика, залежить від відстані, на якій розташована найглибша структура, що становить діагностичний інтерес.
У випадку обстеження серця така відстань зазвичай не перевищує 20 см, а час проходження ультразвуку в обох напрямках займає 260 мікросекунд.
Лише через такий проміжок датчик надішле наступний імпульс. За таких умов кожної секунди датчик випромінює 3750 ультразвукових імпульсів. Цей потік коротких імпульсів називають ультразвуковим променем (Рисована та Радзішевська, 2016).
Щоб створити двовимірне зображення серця (площинний переріз), ультразвуковий промінь повинен швидко рухатися збоку вбік по площині скенування, яка має форму сектора, як промінь маяка, що розшукує кораблі в нічному морі. Кристалічні п’єзоелементи активуються електронним способом у чіткій послідовності, так що малі «хвильки» від кожного кристалика зливаються і утворюють складну ультразвукову хвилю. Щоб отримати зображення серця, яке рухається, необхідно хоча б 25 зрізів за секунду, а за умови, що глибина дослідження становить 20 см, кожен зріз складатиметься зі 150 індивідуальних ліній скенування. Чим ширший кут скенування, тим менша густота ліній скенування і гірша якість загального зображення. Тому для поліпшення «картинки» бажано зменшувати глибину і звужувати сектор скенування (Feigenbaum et al., 2010).
Якщо ділянка тіла, яку обстежують за допомогою ультразвукового методу, містить структури, у яких проведення і згасання ультразвукових хвиль суттєво відрізняються від цих процесів у м’яких тканинах, то виникають особливі артефакти, які часом зумовлюють хибне трактування отриманих зображень. Такі артефакти називаються реверберацією і множинним відлунням.
Ультразвуковий промінь, який проникає через якусь структуру, зазвичай породжує два відлуння (ехо-сигнали) – від проксимальної і від дистальної поверхні. Проте ехо-сигнал, який повертається від дистальної поверхні, повинен пройти на шляху до датчика через проксимальну поверхню. Частина цього сигналу проходить через проксимальну поверхню і повертається до датчика, а інша частина відбивається від цієї поверхні і знову йде в глибину, де повторно відбивається від дистальної поверхні.
Цей процес повторюється багато разів, що породжує множинні зображення, розміщені на екрані глибше за основним зображенням на однакових проміжках, а інтенсивність цих «примарних» зображень прогресивно згасає з глибиною (Lancellotti and Cosyns, 2016).
За звичайних умов цей процес себе не проявляє, бо відлуння від м’яких тканин занадто слабкі. Так, первинний ехо-сигнал за своєю інтенсивністю становить лише приблизно 0,1% інтенсивності ультразвукової хвилі, яка падає на поверхню. Вторинний ехо-сигнал повинен був би ще двічі відбитися, перед тим як повернутися до датчика і бути зафіксованим апаратом, тобто його інтенсивність мала становити 0,1% х 0,1% х 0,1% сили основного сигналу. А це занадто мало, щоб можна було вловити.
Якщо ж об’єкт є дуже сильним рефлектором, наприклад звапнений або протезований клапан, який відбиває понад 10% хвилі, яка падає на нього, тоді вторинні відлуння і навіть відлуння вищого порядку достатньо сильні й можуть бути вловленими датчиком (Otto, 2013).
Інший наслідок високоінтенсивного відлуння – його відбиття від поверхні датчика і повторне проникнення в тіло, що створює за основним зображенням ніби додаткову «картинку-привид». Зрозуміти, що таке зображення є примарним, дозволяє той факт, що воно розміщене рівно у два рази глибше від поверхні датчика, ніж основне зображення, а якщо воно рухається, то рухається рівно у два рази далі.
Щоб уникнути утворення ревербераційних артефактів, потрібно застосовувати якомога менше підсилення. Необхідно мати на увазі, що такі артефакти зазвичай видно лише в якійсь одній площині скенування, і вони не зважають на анатомічні межі (наприклад, клапан нібито міститься на стінці шлуночка, а якась лінійна структура рухається поза серцем взагалі).
Часто, коли обстежують дугу аорти в літніх осіб, ревербераційні артефакти можуть нагадувати відшаровану інтиму і створювати діагностичні труднощі (Feigenbaum et al., 2010).
Звукові сигнали, включно з ультразвуком, який посилають через тканини тіла, містять гармонічні коливання. Це додаткові частоти, кратні до основної частотної складової, яку називають «фундаментальною». У сучасних ультразвукових апаратах застосовують аналіз других гармонічних сигналів від тканин організму, викликаних проходженням через них ультразвукової хвилі. Їх називають «друга гармоніка», тому що їхня частота вдвічі вища за фундаментальну частоту. Якщо для зображення серця використовують аналіз других гармонічних коливань, то зокрема вдається досягти ліпшого окреслення межі ендокарда лівого шлуночка і тим самим підвищити інформативність обстеження.
Чітка візуалізація ендокардіальної лінії особливо важлива для виявлення ділянок вогнищевих розладів скоротливої здатності при ішемічній хворобі серця, особливо під час стрес-ехокардіографічних тестів. Гармонічні коливання генеруються самими тканинами, через які пройшов випромінений датчиком ультразвуковий сигнал, і тому спосіб отримувати зображення за допомогою вловлених гармонічних коливань має назву «нативне тканинне гармонічне зображення – native tissue harmonic imaging – NTHI» (Otto, 2013).
Поліпшення якості ехокардіографічного зображення за допомогою аналізу другої гармоніки можна пояснити насамперед тим, що більше гармонічних коливань генерується на більшій глибині, а тому їх вловлювання компенсує згасання сили ультразвукової хвилі, яка проникає в глибину тканини. Крім того, при використанні другої гармоніки не виникають сильні ревербераційні артефакти в поверхневих шарах, а також зростає роздільна здатність скенування.
Усе це особливо важливо, коли мають справу з поганим «ультразвуковим вікном». Так називають ситуацію, коли обстежуваний пацієнт має надлишкову масу тіла і вузькі міжреберні проміжки або емфізему легень, що значно затрудняє проходження ультразвукової хвилі від датчика на серце (Feigenbaum et al., 2010). Більшість сучасних діагностичних апаратів мають можливість працювати в режимі нативного тканинного гармонічного зображення.
Ехокардіографія є методом, який сам собою не становить загрози для пацієнта. Про це свідчить досвід сотень мільйонів обстежень, проведених за понад 50 років – відтоді, як цей метод було впроваджено в клінічну практику. Ультразвукова хвиля, проникаючи в тіло і згасаючи, віддає свою енергію, яка перетворюється на тепло.
Однак це нагрівання при потужностях ультразвуку, який використовують з діагностичною метою, є настільки мізерним, що не має жодної біологічної дії. Проте нульового ризику не існує, а тому завжди треба керуватися правилом: застосовувати якомога меншу потужність і розумно короткий час ультразвукового опромінення пацієнта.
Стандартні ехокардіографічні перерізи
Зображення серця з парастернального підходу по довгій осі
Ультразвукове дослідження серця зазвичай починають з аналізу зображення, отриманого з парастернального підходу, орієнтуючи площину скенування по довгій осі серця. Для цього датчик прикладають перпендикулярно до передньої грудної стінки в ІІІ або IV міжребер’ях біля лівого краю груднини, а площину скенування орієнтують по уявній лінії, яка з’єднує верхівку серця та середину правої ключиці. Структури серця, розміщені ближче до поверхні датчика, будуть зображені у верхній частині екрана.
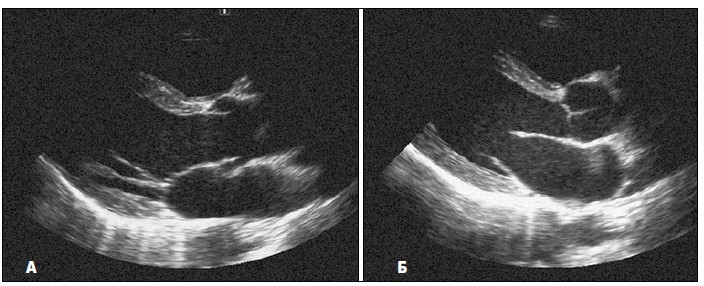
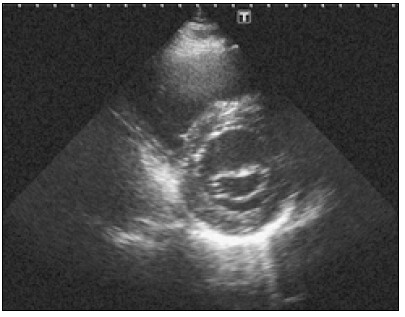
На рис. 1 показано типове зображення, отримане за такого розміщення датчика.
Рис. 1. Зображення серця з парастернального підходу по довгій осі лівого шлуночка. А. Зображення затримане під час систоли. Стулки аортального клапана відкриті, а стулки мітрального клапана — зімкнені. Б. Діастола: стулки аортального клапана зімкнулися, а стулки мітрального клапана відкрилися
Угорі зображення видно (не завжди чітко) передню стінку правого шлуночка, глибше – міжшлуночкову перегородку (МШП), а під нею – порожнину лівого шлуночка з папілярними м’язами, сухожильними хордами і мітральними стулками. У нижній частині екрана міститься зображення задньої стінки лівого шлуночка. МШП безпосередньо переходить у передню стінку аорти. А переднямітральна стулка переходить у задню стінку аорти, що називають мітрально-аортальним фіброзним продовженням (Schlьter et al., 1984).
У корені аорти видно рух лише двох стулок аортального клапана, причому верхньою завжди є права коронарна стулка. Нижня стулка може бути як лівою коронарною, так і некоронарною, що залежить від того, як нахилена площина скенування (Флакскампф, 2013).
Зазвичай стулки аортального клапана видно не досить чітко, бо вони в нормі досить тонкі. Під час систоли стулки візуалізуються як дві паралельні короткі смужки, які прилягають до стінок аорти, а під час діастоли їх часом можна бачити лише в місці, де вони змикаються, тобто в центрі просвіту кореня аорти. Добре видно аортальні стулки тоді, коли вони потовщені, або коли умови для скенування особливо сприятливі (Feigenbaum et al., 2010).
Стулки мітрального клапана завжди видно добре. Під час діастоли при синусовому ритмі, коли є звичайна послідовність скорочення передсердь і шлуночків, мітральний клапан відкривається двічі. Лівий шлуночок, активно розслаблюючись на початку діастоли, засмоктує кров із передсердя. При цьому мітральні стулки розходяться і звисають у порожнину шлуночка. Як тільки закінчиться ранньодіастолічне наповнення шлуночка кров’ю, мітральні стулки ніби спливають у напрямку до передсердя, частково прикриваючись. Це явище називається ранньодіастолічним прикриттям мітрального клапана. Повторне відкриття мітральних стулок настає під впливом систоли передсердя і пізньодіастолічного потоку крові до шлуночка. Амплітуда пізнього діастолічного відкриття мітральних стулок менша, ніж раннього діастолічного (Otto, 2013).
Після цього починається систола шлуночка, і стулки мітрального клапана змикаються. Через короткий проміжок часу (фаза ізометричного скорочення) відкривається аортальний клапан. За нормальних умов стулки аортального клапана повністю відкриті протягом усього періоду систолічного вигнання крові в аорту (Feigenbaum et al., 2010).
Крім руху мітрального та аортального клапанів, потрібно оцінити кінетику стінок серця. Лівий шлуночок можна собі уявити як м’язовий мішечок, близький за формою до конуса.
При скенуванні по короткій осі, коли площина скенування розміщується перпендикулярно до лінії «верхівка серця – середина правої ключиці», лівий шлуночок виглядає як м’язове кільце (Schlьter et al., 1984). Спостерігаючи за його скороченням, бачимо, що стінки рівномірно наближаються до геометричного центра кільця. Одночасно видно, що, скорочуючись, стінки рівномірно потовщуються у всіх сегментах. При дослідженні лівого шлуночка по його довгій осі він виглядає як рівносторонній трикутник, вершиною якого є верхівка серця, а основою – умовна лінія, що з’єднує базальні закінчення протилежних стінок.
Скорочуючись, стінки рівномірно потовщуються, вершина трикутника наближається до основи, а протилежні точки на ребрах цього трикутника наближаються до його осі на однакову відстань, тобто рівномірно.
Таким чином, скорочення стінок лівого шлуночка коротко можна описати так: рівномірно потовщуються, рівномірно наближаючись (Коваленко та ін., 2009).
При парастернальному зображенні лівого шлуночка по довгій осі вдається оцінити рівномірність скорочення двох протилежних стінок – МШП і задньої стінки. Вони рівномірно потовщуються, рівномірно наближаючись. Проте цей ультразвуковий переріз не дає можливості візуалізувати верхівку лівого шлуночка й оцінити її скорочення (Otto, 2013).
Крім висхідного відділу аорти в поздовжньому перерізі, позаду (тобто нижче) від лівого передсердя видно її низхідний відділ у поперечному або злегка косому перерізі.
У передсердно-шлуночковій борозні візуалізується круглястий утвір набагато меншого діаметра, ніж низхідна аорта. Це коронарний синус, який збирає венозну кров від міокарда і несе її до правого передсердя. У 0,5% всіх людей коронарний синус значно ширший, ніж звичайно, і виглядає як додаткова маленька камера, що прилягає ззаду до лівого передсердя (Schlьter et al., 1984).
Причиною такого аневризматичного розширення коронарного синуса в більшості випадків є те, що в нього впадає додаткова ліва верхня порожниста вена. Така анатомічна будова – це аномалія розвитку венозної системи, проте сама собою вона не має патологічного значення, хіба що поєднується з іншими, серйознішими вадами (Feigenbaum et al., 2010).
Вивчення ехокардіографічного зображення з парастернального підходу по довгій осі лівого шлуночка дає змогу:
- виявити патологію кореня аорти (розширення, розшарування);
- розпізнати ураження аортального клапана (аномалії, потовщення, зрощення стулок, кальциноз, вегетації);
- виявити підклапанну обструкцію вихідного тракту (шлях відтоку) лівого шлуночка (мембранозний або м’язовий стенози);
- оцінити функцію лівого шлуночка;
- визначити рухомість, амплітуду рухів і товщину МШП і задньої стінки лівого шлуночка;
- візуалізувати або виявити кольоровим (або імпульсним) допплерівським методом окремі види дефектів МШП і виміряти величину систолічного перепаду тиску між шлуночками;
- побачити мітрально-аортальне фіброзне продовження;
- виявити структурні зміни або розлади функції мітрального клапана і структур, які його підтримують (сухожильні хорди або папілярні м’язи);
- виявити розширення коронарного синуса;
- дослідити ліве передсердя і виявити, якщо вони є, об’ємні утвори в ньому (тромб, міксома) або мембрану;
- провести кольорову допплерівську оцінку мітральної або аортальної недостатності.
Ультразвуковий переріз з парастернального підходу по довгій осі лівого шлуночка є основним: із нього починають ехокардіографічне дослідження, за ним орієнтують вісь одновимірного скенування (М-спосіб) і він є вихідним для отримання інших двовимірних перерізів (Коваленко та ін., 2012).
Якщо, отримавши цей переріз, площину скенування повернути за годинниковою стрілкою і зорієнтувати паралельно до груднини, то можна отримати зображення низхідної аорти позаду від структур серця не по короткій, а по довгій осі, що важливо для розпізнавання аневризм (Feigenbaum et al., 2010).
Щоб вивести клапан легеневої артерії разом із вихідним відділом правого шлуночка та стовбуром легеневої артерії, можна скористатися таким способом.
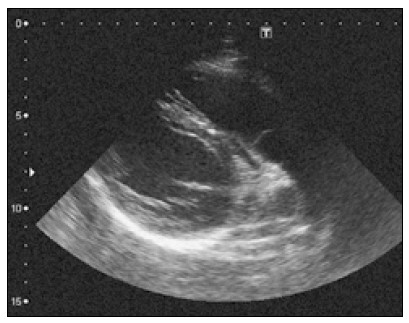
Отримавши зображення серця з парастернального підходу по довгій осі лівого шлуночка, датчик злегка повертають проти годинникової стрілки і нахиляють під гострим кутом до грудної клітки, ніби прагнучи заглянути під лівий плечовий суглоб (рис. 2).
Рис. 2. Зображення вихідного шляху правого шлуночка з парастернального підходу
Якісніше зображення можна отримати, повернувши пацієнта на лівий бік і, крім того, попросивши його затримати дихання на глибокому видиху (Otto, 2013).
Ехокардіографічне зображення вихідного відділу правого шлуночка з парастернального підходу дає змогу:
- виявити звуження вихідного тракту правого шлуночка;
- дослідити стан і рух стулок клапана легеневої артерії;
- візуалізувати проксимальний відділ стовбура легеневої артерії;
- провести вимірювання допплерівських показників потоку крові через клапан легеневої артерії та розрахувати перепади тиску між правим шлуночком і легеневою артерією.
Стулки клапана легеневої артерії рухаються так само, як стулки аортального клапана: вони є «кишеньками», які під час систоли відтискаються потоком крові до стінок артерії, прилягають до неї, і їх може не бути видно, а під час діастоли шлуночка ці «кишеньки» наповнюються кров’ю і змикаються своїми краями, перешкоджаючи зворотному потоку крові до правого шлуночка.
Треба пам’ятати, що в нормі допплерівське дослідження (імпульсним або кольоровим способом) майже завжди виявляє слабкий регургітаційний (зворотний) потік через клапан легеневої артерії, що майже ніколи не трапляється при дослідженні нормального аортального клапана (Lancellotti and Cosyns, 2016).
Із того ж місця, звідки отримано зображення лівого шлуночка по довгій осі, повертаючи датчик так, щоб площина скенування набула нижньосерединного нахилу при легкій ротації за годинниковою стрілкою (нібито «зазираючи» під основу мечоподібного паростка), можна отримати зображення вхідного тракту (шлях притоку) правого шлуночка по довгій осі (рис. 3).
Рис. 3. Зображення вхідного шляху правого шлуночка з парастернального підходу
На цьому зображенні в реальному часі добре видно положення і рух стулок трикуспідального клапана. Передня стулка цього клапана відносно більша та довша, ніж задня або септальна. Нормальний тристулковий клапан відкривається так, як і мітральний: стулки під час діастоли здійснюють подвійний рух (відкриття – прикриття – відкриття).
Причому більшу амплітуду руху мають точки, розташовані ближче до вільного краю стулок, тобто клапан має відкриватися, як дверцята. При стенозі (як тристулковому, так і мітральному) стулки «надуваються» під час діастоли, тобто відкриваються, як купол парашута.
Куполоподібний рух стулок – характерна ознака клапанного стенозу, яку легко виявити під час двовимірного дослідження. На діафрагмальній поверхні серця між правим шлуночком і передсердям вдається візуалізувати на цьому самому перерізі місце впадіння коронарного синуса в праве передсердя (Schlьter et al., 1984).
Зображення серця з парастернального підходу по короткій осі
Щоб отримати зображення серця з парастернального підходу по короткій осі, датчик залишають у ІІІ або IV міжребер’ї біля лівого краю груднини під прямим кутом до передньої грудної стінки і повертають його за годинниковою стрілкою так, щоб площина скенування стала перпендикулярно до довгої осі серця.
У такому положенні, нахиляючи датчик від основи серця до його верхівки, отримують перерізи по короткій осі на різних рівнях (Otto, 2013).
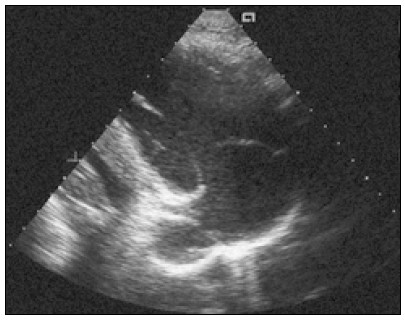
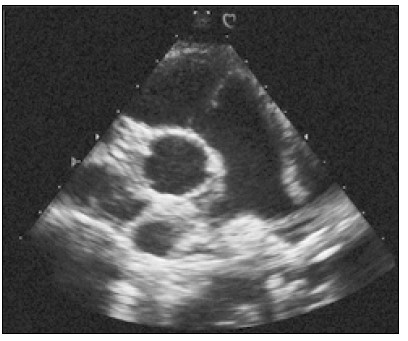
Насамперед отримують парастернальне зображення лівого шлуночка по короткій осі на рівні папілярних (сосочкових) м’язів (рис. 4). Папілярні м’язи на такому перерізі виглядають як два круглясті ехогенні утвори, розташовані ближче до стінки лівого шлуночка. Їх положення в порожнині шлуночка в різних людей може відрізнятися (Lancellotti and Cosyns, 2016).
Рис. 4. Парастернальне зображення по короткій осі на рівні папілярних м’язів. Передньобічний папілярний м’яз у цьому випадку має дві головки, а його більша головка розміщена на 4-й годині, якщо переріз ЛШ уявити собі як циферблат годинника. Саме таке розміщення трапляється в 45% випадків. Інші варіанти: на 3-й годині — 53%, а на 5-й — 2%. Відносна частота розміщення головка задньосерединного папілярного м’яза: 67% — на 8-й годині (як у цьому випадку), 26% — на 7-й, 7% — на 9-й
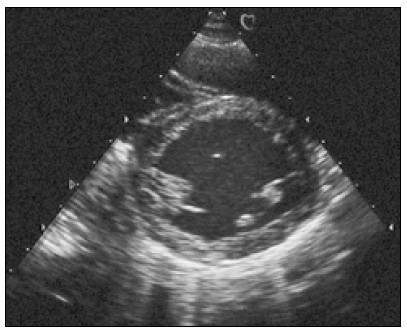
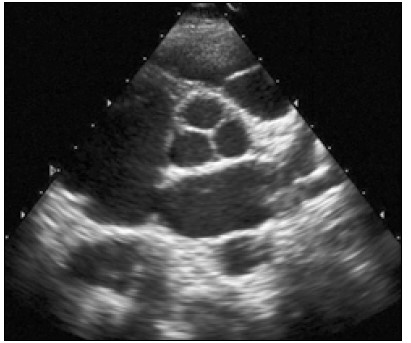
Після того як отримано зображення поперечного перерізу серця на рівні папілярних м’язів, площину скенування нахиляють до основи серця й отримують переріз лівого шлуночка по короткій осі на рівні мітрального клапана (рис. 5).
Рис. 5. Парастернальне зображення по короткій осі на рівні мітрального клапана
Розглядаючи це зображення в русі, треба звернути увагу на такі моменти:
- нормальний рух стулок мітрального і тристулкового клапанів – під час діастоли вони розходяться в протилежні боки, а під час систоли рухаються одна до одної;
- рівномірна циркулярна скоротливість лівого шлуночка – усі його стінки скорочуються, наближаючись до центра на однакову відстань, одночасно потовщуючись; у здоровому серці МШП бере участь у систолі лівого шлуночка, тобто при скороченні наближається до його центра;
- правий шлуночок на цьому перерізі має серпоподібну або близьку до трикутника форму, а його стінка під час систоли рухається в тому самому напрямку, що й МШП.
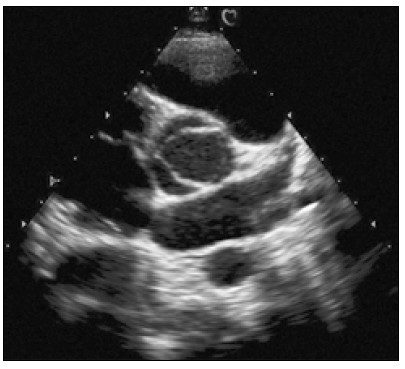
Далі, нахиляючи площину скенування до основи серця, отримують переріз на рівні аортального клапана (рис. 6). У центрі цього зображення – корінь аорти зі стулками аортального клапана (Schlьter et al., 1984). У закритому положенні стулки утворюють фігуру, що нагадує букву Y.
Рис. 6. Парастернальне зображення по короткій осі на рівні аортального клапана. Справа і вгору від аортального клапана видно закриту стулку клапана легеневої артерії, зліва — праве передсердя, внизу — ліве передсердя. Кругляста структура меншого діаметра внизу під лівим передсердям — низхідна аорта
Права коронарна стулка розташована зверху і прилягає до вихідного тракту правого шлуночка. Некоронарна стулка прилягає до правого передсердя, а ліва коронарна стулка – до лівого передсердя.
Вихідний відділ правого шлуночка на зображенні при такому перерізі лежить дугою попереду від кільця аорти. Видно лише початковий відділ стовбура легеневої артерії, однак вдається оцінити стан і рух стулок клапана легеневої артерії (Feigenbaum et al., 2010). Під час систоли стулки аортального клапана відкриваються, утворюючи фігуру, що нагадує трикутник з випуклими сторонами (рис. 7).
Рис. 7. Парастернальне зображення, коротка вісь. Аортальний клапан у відкритій позиції
Цей переріз є вирішальним для розпізнавання найчастішої вродженої вади серця – двостулкового аортального клапана, а також інших його аномалій. При такому самому перерізі часом вдається візуалізувати початкові відрізки вінцевих артерій. У реальному часі (тобто при дослідженні рухомого зображення) гирло та основний стовбур лівої вінцевої артерії видно лише протягом частини серцевого циклу. Особливо важливо оцінити хід правої вінцевої артерії у хворих із тетрадою Фалло. Приблизно в 10% із них вона має аномальний хід спереду від вихідного тракту правого шлуночка, а це створює загрозу її випадкового пересічення під час хірургічної корекції вади.
Якщо площину скенування ще більше нахилити до основи серця, то можна отримати переріз на рівні роздвоєння (біфуркації) легеневої артерії (рис. 8).
Рис. 8. Парастернальне зображення, коротка вісь. Рівень біфуркації легеневої артерії. Угорі — вихідний тракт правого шлуночка і закриті стулки клапана легеневої артерії, а круглястий утвір нижче зліва — висхідний відділ аорти (поперечний переріз відразу вище від аортального клапана). Справа від аорти — основний стовбур легеневої артерії, який розгалужується на дві гілки
У маленьких дітей біфуркацію легеневої артерії вдається легко візуалізувати, якщо прикласти датчик у ІІ міжребер’ї зліва майже перпендикулярно до передньої грудної стінки, а площину скенування зорієнтувати паралельно до ключиці. Між обома гілками легеневої артерії, у глибині, ближче до лівої гілки, можна побачити кільцеподібну структуру – зображення низхідної аорти в поперечному перерізі. Саме між цим кільцем і лівою гілкою легеневої артерії треба шукати відкриту артеріальну протоку за допомогою кольорової допплерографії. Права гілка легеневої артерії «пірнає» під дугу аорти, а тому на цьому зображенні її треба шукати між двома кільцями: вище – висхідний відділ аорти, нижче – низхідний відділ.
Саме цей ультразвуковий переріз дає інформацію про анатомічні особливості легеневої артерії, діаметр її гілок, а також використовується для допплерівського вимірювання в ній швидкості кровоплину та оцінювання його характеру (Feigenbaum et al., 2010).
Продовження читайте у наступному номері.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (88) 2023 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....