Злоякісна меланома шкіри
Уніфікований клінічний протокол первинної та спеціалізованої медичної допомоги
Щорічна захворюваність на злоякісну меланому шкіри (МШ) коливається в межах від 3-5 на 100 тисяч населення (країни Середземномор’я) до 12-35 на 100 тисяч (північні країни), тоді як в Австралії та Новій Зеландії може сягати 50 на 100 тисяч населення. Захворюваність на меланому постійно зростає впродовж останніх 40 років з тенденцією до стабілізації смертності, окрім чоловіків похилого віку.
В уніфікованому клінічному протоколі зосереджено увагу на основних етапах надання медичної допомоги пацієнтам з МШ. Визначальними завданнями при розробленні протоколу було забезпечення якості, ефективності та рівних можливостей доступу до медичної допомоги пацієнтів з МШ, створення єдиних принципів щодо здійснення профілактики, діагностики, лікування та реабілітації хворих, а також обґрунтування кадрового забезпечення та ресурсного оснащення закладу охорони здоров’я.
I. Загальна частина
Пік захворюваності на МШ припадає на 65 років, хоча захворювання може виникнути у будь-якому віці. Також спостерігається зростання показника відношення смертності до захворюваності у східноєвропейських країнах порівняно з країнами Західної Європи. Це свідчить про необхідність покращення заходів з профілактики та раннього виявлення меланоми у країнах Східної Європи, зокрема в Україні.
За даними Національного канцер-реєстру України, у 2020 році діагностовано 2422 нових випадки МШ, померло 844 хворих; стандартизований показник захворюваності (світовий стандарт) склав 4,2 на 100 тисяч населення, стандартизований показник смертності (світовий стандарт) – 1,3 на 100 тисяч населення. З числа вперше виявлених І стадію захворювання мали 33,9%, ІІ стадію – 43,4%, ІІІ стадію – 6,9%, IV стадію – 5,3% хворих; у 10,4% пацієнтів стадію не було встановлено.
МШ може бути запідозрена на основі характерних візуальних ознак і даних анамнезу. Ключове завдання лікарів, які надають первинну та спеціалізовану (неонкологічну) медичну допомогу, – забезпечити якнайшвидше направлення пацієнтів з підозрою на МШ до відповідного закладу охорони здоров’я (ЗОЗ) для підтвердження або спростування діагнозу та надання спеціалізованої медичної допомоги.
Діагноз меланома шкіри встановлюється у ЗОЗ, що надають спеціалізовану медичну допомогу, на основі результатів гістологічного дослідження видаленої пухлини. Поширеність захворювання оцінюють за допомогою додаткових методів дослідження (біопсії сторожового лімфатичного вузла – БСЛВ, ультразвукового дослідження – УЗД, магнітно-резонансної томографії – МРТ, комп’ютерної томографії – КТ, позитронно-емісійної комп’ютерної томографії – ПЕТ-КТ), які дозволяють встановити стадію захворювання та призначити відповідне лікування.
Лікарі загальної практики – сімейні лікарі відіграють важливу роль в організації раннього виявлення МШ, інформування населення щодо МШ та заохоченні до участі у профілактичних обстеженнях, сприянні виконанню усіх рекомендацій спеціалістів під час протипухлинного лікування, забезпеченні належної паліативної допомоги.
II. Основна частина
2.1. Первинна медична допомога
2.1.1. Профілактика
Положення протоколу. Проведення заходів щодо первинної та вторинної профілактики злоякісної МШ відіграє ключову роль у запобіганні та ранньому виявленні МШ.
Первинна профілактика МШ включає уникнення канцерогенної дії зовнішніх і внутрішніх факторів, ведення здорового способу життя, підвищення стійкості організму до шкідливих факторів навколишнього середовища. Вторинна профілактика МШ передбачає раннє виявлення МШ та направлення пацієнта до ЗОЗ, що надає спеціалізовану медичну допомогу, для призначення оптимального лікування.
Обґрунтування. Ультрафіолетове випромінювання (УФВ) визначено основним канцерогеном, що спричиняє розвиток злоякісної МШ. УФВ асоціюється з вираженим пошкодженням ДНК і високим рівнем мутацій. Первинна профілактика спрямована на зменшення впливу відомих факторів ризику, зокрема УФВ (уникнення засмаги, відмова від користування соляріями, носіння одягу з довгими рукавами, капелюхів із широкими полями та сонцезахисних окулярів, регулярне використання сонцезахисних кремів широкого спектра (UVA/UVB) із SPF 15 або вище). Внутрішнім фактором ризику вважається наявність хронічних захворювань і станів, які посилюють шкідливий вплив УФВ. Вторинна профілактика може бути досягнута за допомогою двох методів: самообстеження пацієнтів та огляду медичними працівниками. Популяційний скринінг МШ не рекомендується, оскільки не показав своєї ефективності.
Дії лікаря
Обов’язкові
- Надавати інформацію пацієнтам щодо факторів ризику виникнення МШ, що пов’язані зі способом життя і навколишнім середовищем, та рекомендації щодо необхідності уникнення впливу факторів ризику розвитку МШ і щодо методів захисту від впливу УФВ.
- Надавати інформацію пацієнтам, особливо з наявністю факторів ризику, щодо необхідності самообстеження (спостереження за змінами форми й розміру родимих плям) та оглядати поверхню шкіри таких пацієнтів під час планових візитів.
- Направляти пацієнтів з підозрою на МШ до ЗОЗ, що надають спеціалізовану медичну допомогу, з метою подальшого обстеження та верифікації діагнозу.
Бажані
Інформувати пацієнтів, члени родини яких мають в анамнезі первинну множинну меланому або рак підшлункової залози, нирки та/або молочної залози; астроцитому; увеальну меланому та/або мезотеліому, щодо доцільності проведення генетичного консультування.
2.1.2. Діагностика
Положення протоколу. Діагностичні заходи спрямовуються на раннє виявлення ознак МШ та направлення пацієнта до ЗОЗ, що надають спеціалізовану медичну допомогу, з метою встановлення діагнозу і призначення спеціального протипухлинного лікування.
Обґрунтування. Запідозрити МШ може лікар будь-якої спеціалізації, який у разі виявлення підозрілих щодо меланоми пігментних новоутворень шкіри має направити пацієнта до ЗОЗ, що надають спеціалізовану медичну допомогу. Діагноз МШ підтверджується або спростовується на підставі гістологічного висновку за матеріалами морфологічного дослідження біопсії пухлинного утворення.
Запідозрити МШ можна за наявністю підозрілих пігментних утворень шкіри, що мають одну з ознак згідно з правилом ABCDЕ: А – асиметрія, В – нерівність країв, С – гетерогенність забарвлення, D – діаметр пухлини більше 6 мм, Е – динаміка чи еволюція кольору, форми або розміру. Динаміка (або еволюція) – дуже важливий критерій, який може допомогти в діагностиці безпігментних меланом, що швидко ростуть.
Згідно з концепцією «гидкого каченяти» МШ можна діагностувати, спираючись на її візуальну відмінність від інших пігментних невусів на шкірі людини, які зазвичай схожі один на інший.
Дії лікаря
Обов’язкові
- Збір скарг та анамнестичних даних, спрямованих на виявлення МШ, у тому числі особистого та сімейного анамнезу. Фізикальне обстеження включає повний огляд шкірних покривів і пальпацію регіонарних лімфатичних вузлів (ЛВ).
- У разі підозри на МШ пацієнт має бути направлений до ЗОЗ, що надають спеціалізовану медичну допомогу.
2.1.3. Лікування
Положення протоколу. Спеціальне протипухлинне лікування пацієнтів з МШ здійснюється виключно у ЗОЗ, що надають спеціалізовану медичну допомогу.
Обґрунтування. Доведено, що своєчасно розпочате протипухлинне лікування пацієнтів з МШ на ранніх стадіях (0, ІА) у 98-99% випадків сприяє їх повному одужанню. В інших випадках проведення спеціального протипухлинного лікування забезпечує досягнення тривалої ремісії, покращення загальної виживаності та якості життя пацієнтів.
Дії лікаря
Обов’язкові
- Не призначати пацієнту місцеву терапію на ділянку ураженої шкіри та фізіотерапевтичні процедури на ділянки регіонарних ЛВ у разі їх збільшення до верифікації процесу. Під час обстеження та спеціального лікування сприяти виконанню пацієнтом усіх рекомендацій фахівців (лікарів-онкологів, хірургів-онкологів) щодо дотримання загального плану лікування, системної терапії та спостереження.
- Надавати інформацію пацієнтам на основі даних, наведених в Інформації для пацієнта з меланомою шкіри (панель 1).
Панель 1
Інформація для пацієнта з меланомою шкіри
Доведено, що надмірне сонячне опромінення збільшує ризик розвитку меланоми шкіри, особливо в осіб з обтяженим особистим анамнезом. До факторів ризику виникнення меланоми шкіри належать:
- фактори особистого анамнезу: множинні сонячні опіки впродовж життя, наявність в анамнезі передракових станів (актинічного кератозу) та немеланомного раку шкіри, імуносупресивних станів (трансплантація внутрішніх органів і гемопоетичних клітин, ВІЛ/СНІД), рідкісні генодерматози (пігментна ксеродерма);
- фактори зовнішнього середовища (вплив природного та штучного ультрафіолетового випромінювання, зокрема використання соляріїв; періодична інтенсивна інсоляція зумовлює ризик виникнення меланоми кінцівок і тулуба, а хронічна інсоляція – меланоми шкіри голови, шиї та акральної меланоми;
- генетична схильність, меланома шкіри в сімейному анамнезі (особливо множинна); рак підшлункової залози, нирки та/або молочної залози; астроцитома; увеальна меланома та/або мезотеліома;
- чоловіча стать;
- вік старше 50 років;
- схильність за фенотипом (наявність атипових/диспластичних невусів, наявність більше 100 пігментних невусів, І та ІІ фототипи шкіри (дуже світла та світла шкіра з ластовинням в осіб із рудим та світлим волоссям) за Фіцпатріком).
Пік захворюваності на меланому шкіри припадає на 65 років, хоча захворювання може виникнути у будь-якому віці.
! Якщо у вас наявний хоча б один із факторів ризику, необхідно регулярно самостійно оглядати свою шкіру, а помітивши навіть незначні зміни – негайно звернутися до лікаря.
Симптоми, з якими необхідно негайно звернутися до лікаря-онколога:
- зміна кольору, форми або розміру давньої родимої плями;
- будь-яка родима пляма, що має три або більше кольори і стає несиметричною;
- родима пляма, що кровоточить або свербить;
- будь-яке нове стійке ураження шкіри, особливо якщо воно розростається, пігментоване або на вигляд має судинну структуру, також випадки невизначеного діагнозу;
- нова пігментована лінія на нігтях, особливо якщо вона пов’язана із ураженням нігтя;
- ураження, яке розростається під нігтем.
! Своєчасно розпочате протипухлинне лікування пацієнтів з меланомою шкіри на початкових стадіях (Tis, T1a) у 98-99% випадків сприяє повному одужанню пацієнтів. Своєчасне проведення спеціального протипухлинного лікування забезпечує досягнення тривалої ремісії, покращення загальної виживаності та якості життя пацієнтів.
Діагноз меланома шкіри встановлюють виключно у закладах охорони здоров’я, де надається спеціалізована медична допомога, після повного видалення пухлини шкіри та її гістологічного дослідження.
Залежно від параметрів пухлини можуть бути запропоновані додаткові обстеження: загальноклінічне обстеження, ультразвукове дослідження лімфатичних вузлів або комп’ютерна томографія внутрішніх органів та магнітно-резонансна томографія головного мозку за підозри щодо наявності метастазів.
Підтвердження діагнозу меланоми шкіри є основним параметром, на якому базується тактика наступного обстеження та лікування.
Спеціальне протипухлинне лікування пацієнтів з меланомою шкіри здійснюється виключно у закладах спеціалізованої медичної допомоги та включає хірургічне видалення, медикаментозну терапію протипухлинними препаратами, променеву терапію та їх поєднання.
Тривалість лікування зумовлена видом терапії та її ефективністю. Для оцінки ефективності терапії під час лікування періодично виконують комп’ютерну томографію внутрішніх органів та магнітно-резонансну томографію головного мозку.
Після закінчення спеціального лікування пацієнтам з меланомою пропонується щонайменше 5-річне спостереження та надаються рекомендації щодо необхідності самообстеження (огляд невусів, пальпацію післяопераційного рубця/рубців і периферичних лімфатичних вузлів), а також необхідність планових оглядів у онколога, обсяг яких залежить від стадії захворювання та проведеної терапії.
Вчасне виявлення рецидиву та ранній початок лікування сприяє досягненню тривалої ремісії.
2.1.4. Подальше спостереження
Положення протоколу. Пацієнт після спеціального лікування перебуває на обліку у лікаря загальної практики – сімейного лікаря, лікаря-онколога, який веде необхідну медичну документацію та сприяє дотриманню пацієнтом рекомендацій спеціалістів, у тому числі виконанню плану спостереження.
Пацієнту після спеціального протипухлинного лікування під час спостереження надається симптоматичне лікування, спрямоване на усунення патологічних симптомів з боку органів і систем, лікування інших захворювань і підтримку якості життя. За необхідності пацієнта направляють у заклади, що надають спеціалізовану медичну допомогу.
Пацієнту з прогресуючим захворюванням після завершення спеціального протипухлинного лікування надається адекватне знеболювання, інша паліативна медична допомога, симптоматичне лікування згідно з чинними галузевими стандартами у сфері охорони здоров’я.
Обґрунтування. Доведено, що своєчасне виявлення рецидиву збільшує загальну виживаність пацієнтів з МШ. Деякі форми психотерапії приносять користь пацієнтам з МШ, оскільки справляють позитивний вплив на якість їхнього життя.
Дії лікаря
Обов’язкові
- Забезпечення записів у Медичній карті амбулаторного хворого (форма № 025/о) та контроль дотримання плану спостереження.
- Надання інформації пацієнтам, які перенесли спеціальне протипухлинне лікування, або особі, котра доглядає за пацієнтом, щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень у зв’язку з високою небезпекою виникнення рецидиву або іншої пухлини.
- Надання рекомендацій щодо способу життя, режиму харчування та фізичних навантажень.
- Сприяння дотриманню пацієнтом планових обстежень.
Бажані
Навчання навичок комунікації з хворими на злоякісні новоутворення під час курсів підвищення кваліфікації на базі закладів спеціалізованої допомоги, розроблених на основі рекомендацій психологів.
2.2. Спеціалізована медична допомога (неонкологічна)
2.2.1. Діагностика
Положення протоколу. МШ може бути запідозрена лікарем будь-якої лікарської спеціальності на основі характерних клінічних проявів.
Пацієнти проходять обстеження за направленням лікаря загальної практики – сімейного лікаря або при самозверненні.
Пацієнтів, у яких за результатами обстеження запідозрено МШ, направляють до ЗОЗ, що надає спеціалізовану медичну (онкологічну) допомогу за місцем реєстрації або іншого – за бажанням пацієнта, для подальшого обстеження та проведення спеціального лікування.
Обґрунтування. Діагноз МШ підтверджується або спростовується на основі дерматоскопії та має підтверджуватися результатами патогістологічного дослідження злоякісного новоутворення.
Дії лікаря
Обов’язкові
- Збір анамнестичних даних; фізикальний огляд; лабораторні дослідження: загальний аналіз крові, біохімічний аналіз крові та сечі.
- Інструментальні дослідження: дерматоскопія; електрокардіографія; рентгенографія органів грудної клітки в 2 проекціях; УЗД лімфатичних вузлів шиї, аксилярних, пахвинних ЛВ, органів черевної порожнини (печінки, селезінки) та малого таза.
- Консультація фахівців за необхідності.
Бажані
Обстеження на сифіліс, гепатити В та С, вірус імунодефіциту людини (ВІЛ).
2.2.2. Лікування
Положення протоколу. Спеціальне протипухлинне лікування пацієнтів з МШ здійснюється виключно у ЗОЗ, що надають спеціалізовану медичну допомогу.
Обґрунтування. Доведено, що своєчасне спеціальне протипухлинне лікування сприяє одужанню хворих на МШ, досягненню тривалої ремісії, покращенню загальної виживаності та якості життя.
Дії лікаря
Обов’язкові
- Не призначати пацієнтам з підозрою на МШ фізіотерапевтичні процедури на ділянки ураження шкіри та збільшених ЛВ до верифікації процсу.
- При зверненні пацієнта, який отримує спеціальне лікування, сприяти виконанню ним призначень онколога та інших фахівців, а також проводити огляд з метою виявлення ускладнень спеціального лікування.
2.3. Спеціалізована медична допомога (онкологічна)
2.3.1. Діагностика
Положення протоколу. Діагноз МШ встановлюється у ЗОЗ, що надають спеціалізовану медичну (онкологічну) допомогу, після верифікації шляхом виконання ексцизійної (в рідкісних випадках – інцизійної) біопсії та гістологічного дослідження видаленої пухлини шкіри, що підтверджується гістологічним висновком.
З метою оцінки поширеності захворювання виконується БСЛВ, а також необхідні інструментальні дослідження (УЗД, МРТ, КТ, інші дослідження); на підставі даних обстеження визначається поширення патологічного процесу та встановлюється стадія захворювання.
Перед початком лікування пацієнт має бути обстежений з метою виявлення протипоказань до спеціальної протипухлинної терапії.
Обґрунтування. За допомогою БСЛВ виявляють клінічно приховані метастази у ЛВ (мікрометастази); УЗД призначається при збільшених регіонарних ЛВ для визначення макрометастазів, а за підозри на метастазування у внутрішні органи виконують МРТ головного мозку із внутрішньовенним (в/в) контрастуванням і КТ органів грудної клітки, черевної порожнини й таза із в/в контрастуванням; опціонально – МРТ головного мозку з в/в контрастуванням та ПЕТ-КТ.
Товщина пухлини шкіри за Breslow, що встановлюється шляхом гістологічного дослідження після ексцизійної біопсії пухлини шкіри, є основним параметром, на якому базується діагностично-лікувальна тактика ведення пацієнтів.
Гістологічні параметри пухлини шкіри (товщина за Breslow, наявність/відсутність звиразкування) разом з поширенням захворювання на ЛВ і внутрішні органи зумовлюють стадію захворювання.
Дії лікаря
Обов’язкові
- Детальний збір скарг та анамнестичних даних, включаючи тривалість та симптоми захворювання, їх розвиток; терапію, яка проводилась від початку захворювання; перенесені хвороби, хірургічні втручання, попереднє протипухлинне лікування.
- Фізикальне обстеження включає огляд органів і систем, повний огляд шкірних покривів з пальпацією й оцінюванням розміру регіонарних ЛВ.
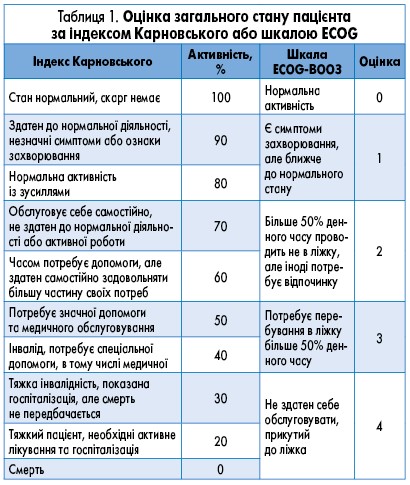
- Оцінювання загального функціонального стану пацієнта за індексом Карновського або шкалою ECOG (табл. 1).
- Лабораторні дослідження: загальний аналіз крові, біохімічний аналіз крові (вміст білка, креатиніну, сечовини, білірубіну, аланінамінотрансферази, аспартатамінотрансферази, глюкози), для виявлення віддалених метастазів – лактатдегідрогенази (ЛДГ).
- Інструментальні дослідження: дерматоскопія новоутворень шкіри – за необхідності; ексцизійна (інцизійна) біопсія пухлини шкіри з подальшим патогістологічним дослідженням матеріалу; УЗД регіонарних ЛВ – за підозри на метастазування; МРТ головного мозку з в/в контрастуванням і КТ органів грудної клітки, черевної порожнини й таза з в/в контрастуванням – за підозри на метастазування у внутрішні органи; остеосцинтиграфія – за підозри на метастази в кістках; за необхідності – ехокардіографія, електрокардіографія, консультації інших фахівців.
Бажані
- ПЕТ-КТ за підозри на метастазування у внутрішні органи.
- Імуногістохімічне (ІГХ) дослідження матеріалу біопсії з метою диференційної діагностики.
2.3.2. Лікування
Положення протоколу. Лікування МШ передбачає застосування хірургічних методів, променевої терапії, лікування антинеопластичними препаратами в різних комбінаціях.
Призначення лікування пацієнтам з МШ здійснюється на підставі визначення стадії захворювання, локалізації пухлини, віку, наявності супутньої патології та загального стану пацієнта.
План лікування пацієнта з МШ складає консиліум фахівців у складі лікарів онколога, хірурга-онколога, променевого терапевта, погоджується з пацієнтом та, за згодою, членами сім’ї/особами, які здійснюють догляд.
Пацієнти з МШ потребують госпіталізації для проведення спеціального протипухлинного лікування за відсутності протипоказань, а також виконання деяких інвазивних діагностичних процедур.
Обґрунтування. Доведено, що основним методом лікування при злоякісній МШ є хірургічний. Але спеціальне протипухлинне лікування пацієнтів з МШ може включати у різному поєднанні хірургічне лікування та лікування терапевтичного профілю – системну терапію у складі таргетної терапії, імунотерапії, хіміотерапії, паліативної терапії, а також променевої терапії (ПТ).
Дії лікаря
Обов’язкові
- Перед початком лікування пацієнт з МШ має бути ознайомлений із переліком можливих втручань, обґрунтуванням їх застосування й очікуваними ризиками та підписати Інформовану добровільну згоду пацієнта на проведення діагностики, лікування та на проведення операції та знеболення (форма № 003-6/о).
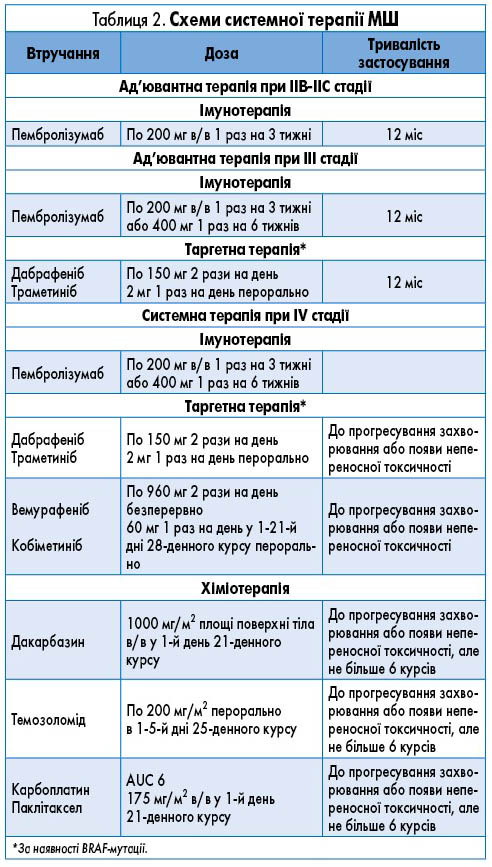
- Вибір протипухлинного лікування пацієнта з МШ залежно від стадії захворювання, локалізації пухлини, віку, загального стану, наявності супутньої патології здійснюється відповідно до пунктів розділу 3.2. Лікування та таблиці 2.
- Моніторинг стану пацієнта, виявлення побічних ефектів спеціального протипухлинного лікування, симптоматична терапія супутньої патології здійснюється відповідно до чинних галузевих стандартів у сфері охорони здоров’я.
- Виписування пацієнта планується відповідно до таких критеріїв: завершення запланованого обсягу/етапу лікування, відсутність ускладнень терапії, що потребують перебування в стаціонарі, неможливість продовження спеціальної терапії у зв’язку з розвитком протипоказань.
- Пацієнту, який переніс спеціальне лікування, надається інформація щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень відповідно до Плану спостереження, а також рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
2.3.3. Подальше спостереження
Положення протоколу. У зв’язку з високою небезпекою подальшого прогресування захворювання пацієнти з МШ підлягають спостереженню з плановими оглядами у ЗОЗ, що надає спеціалізовану медичну допомогу, у якому вони отримували лікування, або за місцем реєстрації впродовж щонайменше 5 років.
План спостереження визначається стадією захворювання та проведеним лікуванням.
Обґрунтування. Виконаня оглядів та обстежень відповідно до погодженого плану спостереження сприяє ранньому виявленню місцевого рецидиву пухлини, метастазів у регіонарні ЛВ та внутрішні органи та/або іншої пухлини.
Дії лікаря
Обов’язкові
- Забезпечення ведення Реєстраційної карти хворого на злоякісне новоутворення (форма № 030-6/о) та відображення в ній результатів проведених обстежень. Після спеціального лікування спостереження пацієнтів з МШ здійснюється відповідно до плану. Пацієнтам, які перенесли спеціальне лікування, надається інформація щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень у зв’язку з високою небезпекою виникнення рецидиву або іншої пухлини, а також рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
- Пацієнти з МШ мають бути навчені навичкам самоспостереження (візуальний огляд і пальпація післяопераційного рубця, ЛВ, самостійний огляд усієї поверхні шкіри).
III. Опис етапів медичної допомоги
3.1. Діагностика
Фактори ризику виникнення МШ:
- фактори особистого анамнезу (множинні сонячні опіки впродовж життя), наявність в анамнезі передракових станів (актинічного кератозу) та немеланомного раку шкіри, імуносупресивних станів (трансплантація внутрішніх органів і гемопоетичних клітин, ВІЛ/СНІД), рідкісні генодерматози (пігментна ксеродерма);
- фактори зовнішнього середовища (вплив природного та штучного УФВ, зокрема використання соляріїв; періодична інтенсивна інсоляція викликає ризик виникнення меланоми кінцівок і тулуба, а хронічна інсоляція – ризик меланоми шкіри голови, шиї та акральної меланоми;
- генетична схильність: наявність мутацій зародкової лінії або поліморфізмів, що сприяють меланомі, наприклад, CDKN2a, CDK4, MC1R, BAP1 (особливо для увеальної меланоми), TERT, MITF, PTEN та потенційні інші гени, меланома шкіри в сімейному анамнезі (особливо множинна); рак підшлункової залози, нирки та/або молочної залози; астроцитома; увеальна меланома та/або мезотеліома;
- чоловіча стать;
- вік старше 50 років;
- схильність за фенотипом (наявність атипових/диспластичних невусів, наявність більше 100 пігментних невусів, І та ІІ фототипи шкіри (дуже світла та світла шкіра з ластовинням в осіб із рудим та світлим волоссям) за Фіцпатріком).
Зовнішні ознаки, за якими може бути запідозрена МШ:
1) правило ABCDЕ:
А – асиметрія;
В – нерівність країв;
С – гетерогенність забарвлення;
D – діаметр пухлини більше 6 мм;
Е – динаміка чи еволюція кольору, форми або розміру; динаміка (або еволюція) – дуже важливий критерій, який може допомогти в діагностиці безпігментних меланом, що швидко ростуть;
2) концепція «гидкого каченяти»: МШ можна діагностувати, спираючись на її візуальну відмінність від інших пігментних невусів на шкірі людини, які зазвичай схожі один на інший.
Фізикальний огляд пацієнтів з МШ:
- виконується огляд усієї поверхні шкіри з особливою увагою до будь-яких пігментних утворень, підозрілих на сателіти пухлини, транзиторні метастази (ТМ);
- пальпація регіонарних ЛВ;
- оцінюється загальний стан пацієнта за індексом Карновського або шкалою ECOG (табл. 1).
Дерматоскопія. Специфічними дерматоскопічними ознаками є: меланоми – атипова пігментна сітка, атипові коричнево-чорні точки/глобули, відростки та пігментація з множинними асиметрично розподіленими кольорами, біло-синя вуаль і поліморфні судини; злоякісної лентиго-меланоми на обличчі – патерн з кільцево-зернистим малюнком, гіперпігментовані фолікулярні отвори, ромбоподібні структури та атипова псевдосітка; акральної меланоми – патерн паралельних гребенів та нерівномірна дифузна пігментація.
Автоматизована дерматоскопічна система повного картування тіла покращує діагностичну точність у пацієнтів із множинними атиповими невусами під час їх динамічного спостереження.
Підозра на наявність безпігментної меланоми виникає, коли ураження не має жодного з добре відомих дерматоскопічних ознак меланоцитарних або немеланоцитарних уражень та наявні поліморфні судини. У таких випадках рекомендоване термінове видалення будь-якого підозрілого ураження шкіри.
Ексцизійна повношарова біопсія. З метою верифікації діагнозу виконується повне видалення пухлини хірургічним шляхом з підлеглою підшкірною жировою клітковиною з відступом від краю пухлини 2-3 мм. Такий вид біопсії дозволяє виконати повноцінне гістологічне дослідження з точним встановленням товщини пухлини за Breslow та вивчити краї резекції.
Інцизійна біопсія виконується, коли ексцизійна біопсія технічно неможлива, наприклад, при злоякісній лентиго-меланомі, акральній меланомі або меланомі слизових оболонок. У таких випадках попередньо проводиться дерматоскопія для визначення найбільш підозрілої ділянки.
Патоморфологічний висновок результатів біопсії має містити таку інформацію:
- анатомічну локалізацію пухлини – назву процедури оперативного втручання;
- гістологічний тип: поверхнево-поширена меланома, злоякісна лентиго-меланома, акральна меланома, вузлова меланома та інші (обов’язковий параметр);
- дані щодо наявності звиразкування на поверхні (обов’язковий параметр);
- товщину пухлини за Breslow з похибкою 0,1 мм (обов’язковий параметр);
- анатомічний рівень інвазії за Clark;
- показник мітотичної активності;
- вираженість інфільтрації імунними клітинами;
- дані щодо регресування, лімфоваскулярної та периневральної інвазії;
- відомості щодо наявності сателітних і мікросателітних метастазів;
- дані щодо асоціації з невусом;
- статус хірургічних країв резекції.
При дослідженні матеріалу лімфодисекції слід зазначати такі дані:
- хірургічну процедуру (БСЛВ, повна регіонарна лімфодисекція тощо);
- анатомічну локалізацію видалених ЛВ;
- кількість досліджених ЛВ (специфікуючи кількість вивчених сторожових ЛВ);
- кількість уражених ЛВ;
- кількість метастатичних депозитів у ЛВ;
- локалізацію метастазу (метастазів) у ЛВ;
- розмір найбільшого метастатичного депозиту;
- екстранодальне поширення пухлини;
- наявність чи відсутність конгломератів ЛВ.
За наявності матеріалу віддалених метастазів дані щодо метастатичного ураження також можуть бути включені до висновку.
3.1.1. Додаткові дослідження
Пацієнти з меланомою низького ризику (pTis, pT1a) не потребують додаткових досліджень і виконання БСЛВ. Для інших категорій Т (pT1b-pT4b) рекомендовано проведення УЗД регіонарних ЛВ.
У разі підозри на метастатичне ураження регіонарних ЛВ діагноз підтверджується шляхом виконання тонкоголкової біопсії та цитологічного дослідження.
При первинних МШ з товщиною пухлини за Breslow понад 1 мм та без клінічних або ультразвукових ознак ураження регіонарних ЛВ біопсія сторожових ЛВ є найважливішим прогностичним фактором.
Пацієнтам з ураженням регіонарних ЛВ та підозрою на метастазування у внутрішні органи для оцінювання поширеності захворювання виконується МРТ головного мозку із в/в контрастуванням і КТ органів грудної клітки, черевної порожнини й таза з в/в контрастуванням; як альтернатива – МРТ головного мозку із в/в контрастуванням та ПЕТ-КТ (за можливості). Рішення щодо проведення зазначених інструментальних досліджень у пацієнтів з наявністю мікрометастазів у сторожових ЛВ (N1a або N2a) приймається індивідуально.
У разі первинно-локалізованої МШ дуже високого ризику (IIC стадія) може бути розглянуте призначення інструментальних досліджень.
Пацієнтам з ТМ через високий ризик як локорегіонарного, так і системного метастатичного поширення для оцінювання поширеності захворювання бажано за можливості призначити ПЕТ-КТ.
За наявності віддалених метастазів дослідження рівня ЛДГ у сироватці крові важливе для визначення прогнозу та є одним з критеріїв вибору системної терапії.
Визначення BRAF-статусу:
- проводиться у разі використання таргетної терапії BRAF- та МЕК-інгібіторами при меланомі ІІІ та IV стадії;
- рекомендоване після резекції МШ ІІВ-IIC стадії високого ризику.
Якщо при МШ наявний ген BRAF «дикого» типу (WT) в локусі V600 (BRAF клас I), необхідно провести секвенування локусів інших відомих мінорних мутацій BRAF (BRAF клас II та III) для підтвердження «дикого» типу гена та визначення статусу мутацій у генах NRAS та c-kit.
Стадіювання МШ має відповідати 8-й редакції класифікації TNM (tumour, node, metastasis) Американського об’єднаного комітету з раку (AJCC).
3.2. Лікування
Основні схеми системної терапії МШ та її тривалість представлені у таблиці 2.
3.2.1. Первинна локалізована МШ
Хірургічне лікування. Широке хірургічне видалення післябіопсійного рубця (пухлини шкіри, якщо виконувалась інцизійна біопсія) рекомендується проводити впродовж 4-6 тижнів після встановлення діагнозу з такими відступами:
- для меланоми in situ (pTisN0M0) – 0,5 см;
- при товщині пухлини шкіри за Breslow <2 мм (pT1a-pT2NxM0) – 1 см;
- при товщині пухлини шкіри за Breslow >2 мм (pT3a-pT4bNxM0) – 2 см.
Модифікації з меншими краями резекції можуть бути прийнятними для збереження функції при акральних меланомах і меланомах обличчя та можуть проводитись за допомогою техніки slow-Mohs.
Широке висічення МШ спрямоване на покращення локального контролю шляхом видалення невизначених мікросателітів і зниження вірогідності поширення пухлини у регіонарні ЛВ і внутрішні органи.
За наявності резектабельної первинної МШ з ураженням ЛВ слід виконувати широке висічення первинної пухлини шкіри з чистими краями резекції, проте з первинним закриттям рани для уникнення реконструкції, коли це можливо, оптимально – з відступом 1 см.
У разі IV стадії захворювання за відсутності симптомів або потреби у діагностиці немає необхідності видаляти первинну пухлину. Якщо є показання до видалення первинного ураження, то головною метою є досягнення чистих країв резекції без додаткових відступів.
Променева терапія. ПТ як самостійний метод лікування розглядається в таких (рідкісних) паліативних випадках: злоякісне лентиго (ПТ може мати лікувальний характер та є опцією для запобігання хірургічному втручанню з неприйнятним ефектом); неможливість виконання операції через тяжкі супутні захворювання або дуже похилий вік пацієнта.
Ад’ювантна терапія. Пацієнтам з локалізованою ІІВ-ІІС (T3b-T4bN0M0) стадією МШ як ад’ювантна терапія пропонується імунотерапія пембролізумабом впродовж 12 міс.
Схема лікування наведена у таблиці 2.
Таргетна терапія BRAF- та МЕК-інгібіторами при МШ ІІВ-ІІС стадії як ад’ювантна терапія не рекомендована.
Показання до ад’ювантної ПТ після видалення первинної МШ:
- неадекватні краї резекції злоякісного лентиго (резекція R1 – мікроскопічна пухлина в краях);
- резекція об’ємної пухлини.
3.2.2. Локорегіонарна МШ
Лікування метастазів меланоми представлене у таблиці 3.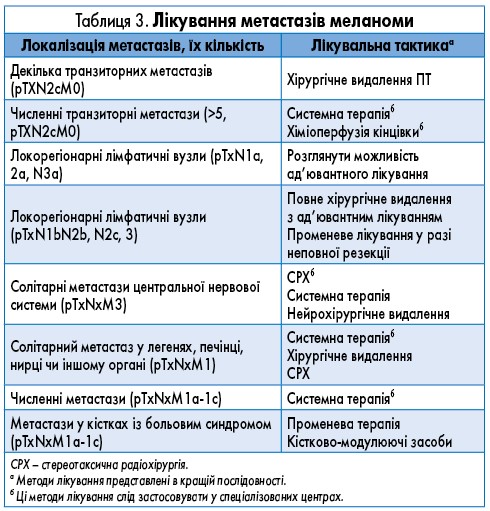
Біопсія сторожового лімфатичного вузла. БСЛВ рекомендована для уточнення стадії МШ категорії pT1b (пухлин товщиною >0,8 мм або товщиною <0,8 мм зі звиразкуванням) та не рекомендується при МШ категорії pT1a.
БСЛВ проводиться одночасно з широким висіченням післябіопсійного рубця або первиної пухлини (у разі виконання інцизійної біопсії) у межах безпечних країв для уникнення модифікацій лімфовідтоку.
Для виявлення сторожових ЛВ використовують радіонуклідний метод із введенням технецію або спеціального барвника – індоціаніну зеленого.
Для виявлення мікрометастазів проводиться ІГХ-дослідження сторожових ЛВ. Зрізи досліджуваних ЛВ у парафінових блоках не мають перевищувати 2-3 мм з подальшим проведенням серійних зрізів щонайменше на 3 рівнях. При виконані серійних зрізів слід здійснювати зрізи як для фарбування гематоксиліном та еозином, так і для проведення ІГХ-дослідження. Слід використовувати щонайменше 3 меланоцитоспецифічних антитіла для підвищення вірогідності виявлення метастазу (SOX10 (SRY-box 10), S100, HMB-45, Melan A, тирозиназа, MITF (microphthalmia-associated transcription factor) тощо).
Висновок дослідження БСЛВ має містити таку інформацію:
- локалізацію досліджених сторожових ЛВ;
- кількість досліджених ЛВ;
- кількість уражених сторожових ЛВ (обов’язковий параметр);
- кількість метастазів у ЛВ;
- локалізація метастазу (метастазів);
- розмір найбільшого метастатичного депозиту;
- статус екстранодального поширення – формування конгломератів ЛВ тощо.
У складних випадках рекомендується перегляд і порівняння гістологічних препаратів первинної пухлини з результатами БСЛВ.
Повна регіонарна лімфодисекція (ПЛД) для пацієнтів з позитивними сторожовими ЛВ не рекомендована.
Виконання ПЛД показане за наявності метастазів у ЛВ, що клінічно визначаються (макрометастазів), – видалення окремих уражених пухлиною ЛВ є недостатнім. Перед проведенням хірургічного втручання необхідне детальне обстеження, яке включає МРТ головного мозку з в/в контрастуванням і КТ органів грудної клітки, черевної порожнини й таза із в/в введенням контрастної речовини (за можливості – МРТ головного мозку із в/в контрастуванням і ПЕТ-КТ) для виключення наявності віддалених метастазів.
Особливості виконання ПЛД залежно від зони ураження:
- за наявності макрометастазів у пахвинній ділянці та за відсутності ознак ураження здухвинних ЛВ на КТ або ПЕТ-КТ (за можливості) достатньо провести пахвинну лімфодисекцію;
- якщо на КТ або ПЕТ-КТ є ознаки ураження здухвинних ЛВ, необхідно виконати пахвинно-здухвинну лімфодисекцію;
- при ураженні аксилярних ЛВ здійснюють аксилярну лімфодисекцію із включенням ЛВ І-ІІІ рівнів;
- у разі ураження шийних ЛВ рекомендується виконання модифікованої радикальної лімфодисекції;
- паротидектомію слід проводити лише за наявності ознак ураження привушної слинної залози.
Сателітні та транзиторні метастази. Пацієнти з резектабельними солітарними, сателітними або транзиторними метастазами можуть бути кандидатами на хірургічне лікування.
При нерезектабельних сателітних, транзиторних метастазах або неоперабельних первинних пухлинах кінцівок без додаткових метастазів можна використовувати ізольовану перфузію кінцівки з використанням мелфалану.
Ад’ювантна ПТ після ПЛД підвищує локальний контроль, її можна застосовувати у специфічних випадках, наприклад, при меланомі голови та шиї.
Показання до призначення ад’ювантної ПТ після виконання ПЛД:
- метастатичне ураження 4 і більше ЛВ;
- екстракапсулярне поширення пухлини;
- розмір ураженого ЛВ >3 см.
Ад’ювантна системна терапія. Пацієнтам з метастатичним ураженням регіонарних ЛВ як ад’ювантна терапія може бути запропонована імунотерапія пембролізумабом або за наявності BRAF-мутації – таргетна терапія BRAF- та МЕК-інгібіторами впродовж 12 міс.
У пацієнта з меланомою та BRAF-мутацією необхідно приймати індивідуалізоване рішення щодо застосування дабрафенібу/траметинібу проти PD-1-блокаторів, враховуючи профілі токсичності.
Комбінація BRAF- та МЕК-інгібіторів дабрафеніб/траметиніб призначається як ад’ювантна терапія меланоми ІІІ стадії. Комбінація вемурафеніб/кобіметиніб призначається лише для лікування IV стадії меланоми з ВRAF-мутацією.
Пацієнти з повністю видаленими сателітними та транзиторними метастазами без ознак метастатичного ураження ЛВ належать до групи високого ризику рецидиву та смерті від меланоми, подібного до ризику рецидиву та смерті для інших категорій раку III стадії, при якій показана ад’ювантна терапія. Тому ад’ювантна терапія може бути розглянута і для цієї категорії хворих.
3.2.3. Нерезектабельна/метастатична МШ
Лікування метастазів меланоми подане у таблиці 3.
Хірургічне лікування. Хірургічне видалення чи стереотаксичне опромінення локорегіонарного рецидиву або поодинокого віддаленого метастазу слід розглядати у придатних пацієнтів, переважно у поєднанні з ад’ювантною системною терапією.
Системне лікування нерезектабельної МШ III та IV стадій. Як першу лінію системного лікування при нерезектабельній МШ ІІІ/IV стадії призначають:
- імунотерапію – PD-1-блокатор (пембролізумаб);
- за наявності BRAF-мутації V600 – таргетну терапію (комбінація вемурафенібу та кобіметинібу або дабрафенібу та траметинібу).
Комбінація BRAF- та MEK-інгібіторів має переваги перед монотерапією BRAF-інгібіторами щодо рівня відповіді, виживаності без прогресування та загальної виживаності. Тому терапію BRAF-інгібіторами у монорежимі слід використовувати лише за наявності абсолютних протипоказань до призначення МЕК-інгібіторів.
Прогностичними та предиктивними маркерами як для таргетної, так і для імунотерапії є загальний стан за ECOG, рівень ЛДГ і кількість уражених метастазами органів.
Хіміотерапія (ХТ) – дакарбазин чи темозоломід або інші лікарські засоби залишаються альтернативною паліативною терапією чи терапією переходу.
Перша лінія терапії. Незалежно від статусу BRAF, PD-1-блокатори є стандартом першої лінії лікування для усіх пацієнтів з меланомою, за винятком таких випадків у пацієнтів з BRAF-мутацією V600:
- високий рівень ЛДГ;
- високе пухлинне навантаження;
- агресивний перебіг хвороби, що залишить недостатньо часу для розвитку ефективної протипухлинної імунної відповіді.
При меланомі з NRAS-мутацією також рекомендоване призначення імунотерапії у першій лінії.
Якщо прогресування захворювання відбулось на фоні ад’ювантної терапії таргетними чи імунотерапевтичними засобами або впродовж перших 6 міс після її закінчення, слід надавати перевагу альтернативним препаратам.
При прогресуванні захворювання більше ніж через 6 міс після закінчення ад’ювантного лікування можна розпочати терапію препаратом, який використовувався в ад’ювантному режимі, або лікарським засобом альтернативного класу.
Друга лінія терапії. Вибір другої лінії терапії залежить від стратегії, використаної у першій лінії, та мутаційного статусу захворювання. Для захворювання з геном BRAF «дикого» типу варіанти другої лінії дуже обмежені, тому з пацієнтом може бути обговорено включення до клінічних досліджень та/або персоналізований підхід, у тому числі ХТ дакарбазином або темозоломідом.
При МШ з BRAF-мутацією у другій лінії пропонується комбінована таргетна терапія BRAF- та MEK-інгібіторами, якщо вони не були використані в першій лінії лікування.
Пацієнтам, у яких прогресування захворювання відбулося на фоні таргетної терапії першої лінії та імунотерапії в другій лінії, може бути повторно призначена таргетна терапія.
Підходи до вибору тактики лікування у пацієнтів з нерезектабельною МШ III та IV стадії представлені на рисунку.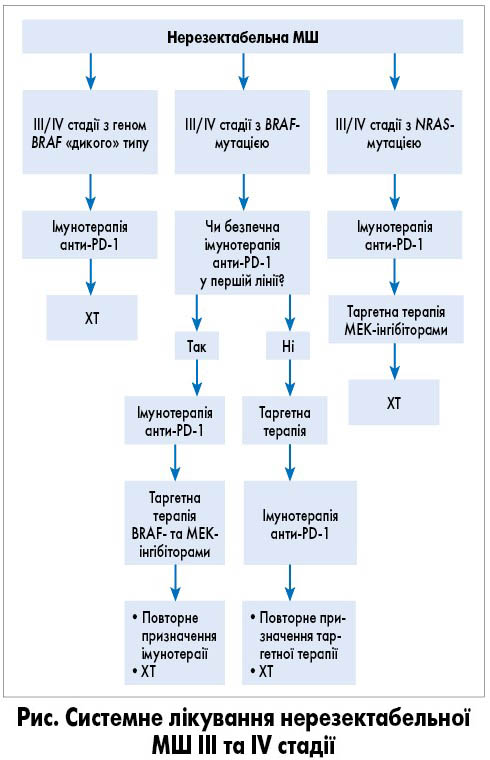
Критерії припинення системної терапії при нерезектабельній МШ III та IV стадії. Не рекомендовано припиняти таргетну терапію з наступним спостереженням при досягненні повної, часткової відповіді або стабілізації захворювання.
Критерії припинення імунотерапії метастатичної меланоми:
- досягнення повної відповіді: імунотерапія тривалістю не менше 6 міс і повна відповідь, двічі поспіль підтверджена методами візуалізації (перевага надається ПЕТ-КТ за можливості проведення);
- досягнення часткової відповіді та стабілізації: після 2 років терапії, може обговорюватися після як мінімум 6 міс імунотерапії та повної патоморфологічної/метаболічної відповіді.
Необхідно пам’ятати, що при застосуванні імунотерапії у 7% хворих можуть спостерігатись явища атипового прогресування або псевдопрогресування.
Метастази меланоми в головному мозку. Поширення метастазів меланоми у головний мозок свідчить про несприятливий прогноз для пацієнтів. Такі хворі потребують мультидисциплінарної допомоги у спеціалізованих центрах.
Системна терапія (таргетна й імунотерапія) можуть бути розглянуті та застосовані разом з нейрохірургією та СРХ. Сеанси СРХ можна поєднувати з системною таргетною або імунотерапією, необхідний контроль захворювання за допомогою МРТ, щоб за потреби додати СРХ. СРХ є терапією першого вибору для пацієнтів з невеликою кількістю безсимптомних метастазів (<5-10), необ’ємним ураженням (<3 см). В інших випадках спочатку призначають системну терапію, застосовуючи СРХ для лікування резистентних пухлинних вогнищ. Для пацієнтів, у яких системне лікування було неефективним, СРХ можна розглядати як рятівну терапію, якщо загальна кількість прогресуючих пухлинних вогнищ становить <5-10, а їх максимальний розмір <3 см.
Необхідно уникати повного опромінення головного мозку, якщо це можливо, через недостатню ефективність та тривалу токсичність цього методу.
У пацієнтів з метастазами у головному мозку, у яких локальна терапія виявилася неефективною або які мають неврологічні симптоми, що потребують введення кортикостероїдів, або з лептоменінгеальними захворюваннями імунотерапія часто є неефективною. Таким пацієнтам призначають повне опромінення головного мозку (навіть у разі лептоменінгеальної або значно поширеної хвороби) та системну терапію BRAF- та MEK-інгібіторами за наявності BRAF-мутації чи темозоломід у разі наявності гена BRAF «дикого» типу.
За необхідності протисудомна терапія може бути призначена одночасно з імунотерапією, проте це призводить до підвищення концентрації та відповідно токсичності таргетних препаратів (крім леветирацетаму).
Якщо у пацієнта є необхідність постійно приймати кортикостероїди (>10 мг преднізолону або еквівалент) на початку системного лікування, тоді слід надати перевагу таргетній терапії перед імунотерапією.
За необхідності одночасного призначення таргетної терапії та повного опромінення головного мозку рекомендовано перервати лікування BRAF- та MEK-інгібіторами; під час проведення СРХ пацієнт може продовжувати прийом таргетних препаратів.
Після повної резекції метастазів у головному мозку або СРХ не рекомендується повного опромінення головного мозку, водночас може бути розглянуте питання щодо проведення СРХ після повної резекції метастазів у головному мозку.
Особливості лікування метастазів меланоми представлені у таблиці 3.
3.3. Подальше спостереження
Пацієнтам, які перенесли спеціальне лікування, надається інформація щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень у зв’язку з високою небезпекою виникнення рецидиву або іншої пухлини, а також рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
Пацієнти з меланомою повинні бути поінформовані щодо:
- необхідності уникнення сонячних опіків, тривалого незахищеного сонячного чи штучного УФВ, необхідності використання сонцезахисних засобів;
- необхідності самоспостереження, що включає огляд невусів, пальпацію післяопераційного рубця/рубців і периферичних ЛВ, а також необхідності планових оглядів у онколога.
Пацієнти з меланомою перебувають під спостереженням щонайменше впродовж 5 років.
На 1-му році спостереження планові огляди та відповідні обстеження проводять 1 раз на 3 міс, на 2-3-му році – 1 раз на 6 міс, на 4-5-му році – 1 раз на рік.
Перелік обстежень визначається стадією захворювання та наявністю додаткових факторів ризику (наприклад, синдрому множинних невусів, сімейного й особистого анамнезу меланоми).
Перелік обстежень, що виконуються під час спостереження пацієнтів з МШ. Фізикальний огляд пацієнта включає:
- оцінку скарг і симптомів;
- огляд і пальпацію післяопераційного рубця/рубців;
- пальпацію периферичних ЛВ;
- загальний клініко-дерматоскопічний огляд шкіри.
Пацієнти з 0 та ІА стадіями захворювання не потребують будь-яких додаткових інструментальних методів дослідження.
Пацієнтам з ІВ-ІІС стадією захворювання призначається УЗД периферичних ЛВ.
Пацієнтам з ІІС стадією високого ризику за необхідності призначається КТ органів грудної клітки, черевної порожнини й таза із в/в контрастуванням або за можливості ПЕТ-КТ.
Пацієнтам з ІІІ-IV стадією призначають МРТ головного мозку з в/в контрастуванням і КТ органів грудної клітки, черевної порожнини й таза із в/в введенням контрастної речовини або за можливості – МРТ головного мозку з в/в контрастуванням та ПЕТ-КТ під час кожного планового візиту до онколога.
Крім того, за потреби може бути призначено дослідження крові на ЛДГ і S-100 протеїн.
IV. Ресурсне забезпечення виконання протоколу
На момент затвердження даного уніфікованого клінічного протоколу засоби матеріально-технічного забезпечення дозволені до застосування в Україні. При розробленні та застосуванні внутрішніх документів ЗОЗ необхідно перевірити реєстрацію в Україні засобів матеріально-технічного забезпечення, які включаються до внутрішніх документів ЗОЗ, та відповідність призначення лікарських засобів Інструкції для медичного застосування лікарського засобу, затвердженій МОЗ України. Державний реєстр лікарських засобів України міститься за посиланням: http://www.drlz.com.ua/ibp.
V. Індикатори якості медичної допомоги
Перелік індикаторів якості медичної допомоги
- Наявність у лікаря загальної практики – сімейного лікаря клінічного маршруту пацієнта з МШ.
- Наявність у лікаря, який надає спеціалізовану медичну допомогу, клінічного маршруту пацієнта пацієнта з МШ.
- Частка пацієнтів, для яких отримано інформацію щодо медичного стану впродовж звітного періоду.
- Частка випадків МШ, виявлених протягом звітного періоду, для яких діагноз підтверджено гістологічно.
- Виживаність пацієнтів з МШ.
***
Уніфікований клінічний протокол медичної допомоги розроблений на основі адаптованої клінічної настанови «Меланома шкіри», яка ґрунтується на принципах доказової медицини з урахуванням сучасних міжнародних рекомендацій. Ознайомитися з текстом клінічної настанови «Меланома шкіри» можна за посиланням: https://www.dec.gov.ua/cat_mtd/galuzevi-standarti-ta-klinichni-nastanovi.
Робочу групу з розробки галузевих стандартів медичної допомоги за темою «Злоякісна меланома шкіри», до якої увійшли представники різних медичних спеціальностей (онкологи, хірурги-онкологи, лікарі-патологоанатоми, дерматологи), створено наказом Міністерства охорони здоров’я України від 18 серпня 2020 року № 1908 (у редакції наказу Міністерства охорони здоров’я України від 16 лютого 2021 року № 265).
Текст адаптовано та уніфіковано відповідно до стандартів тематичного випуску Медичної газети «Здоров’я України».
Повний текст уніфікованого протоколу на сайті https://moz.gov.ua.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (84) 2023 р.
СТАТТІ ЗА ТЕМОЮ Дерматологія
У лютому відбувся онлайн-майстер-клас «Персоніфікація сучасної медицини. Важливі питання гендерних особливостей перебігу захворювань внутрішніх органів. Вплив психоемоційних та інших складових», організований кафедрою терапії, інфекційних хвороб і дерматовенерології Інституту післядипломної освіти Національного медичного університету ім. О.О. Богомольця (м. Київ), а також ГО «Українська академія функціональної медицини та гастропсихології» (м. Київ). ...
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....




