Участь еритроцитів і позаклітинного гемоглобіну у формуванні тромбів
Еритроцити, або червоні кров’яні тільця, є найпоширенішим компонентом клітин крові, які становлять 40-45% їхнього обсягу. Плазматична мембрана еритроцитів має унікальну будову, що надає їм біологічних і механічних властивостей, необхідних для виконання специфічних функцій. Основна функція еритроцитів в організмі – це транспорт кисню, опосередкований гемоглобіном. Вони активно беруть участь як в артеріальних, так і у венозних тромбозах [1]. Гемоглобін – висококонсервативний білок, який завдяки своїй здатності зворотно зв’язувати кисень бере участь у процесах, що лежать в основі аеробного життя на планеті Земля. Головна роль цього білка полягає у підтримці клітинного гомеостазу. Однак завдяки майже 200-річним дослідженням гемоглобіну тепер відомо, що цей білок також відіграє важливу роль в інших метаболічних процесах, як-от передача сигналів у клітинах, модуляція запальної реакції, за тромбозу при гемолізі еритроцитів тощо [2-4].
Механізм участі еритроцитів у формуванні тромбу
Постійно зростає кількість клінічних даних, що свідчать про активну роль еритроцитів у гемостазі. Перше клінічне спостереження щодо ролі еритроцитів у системі згортання крові опубліковано в 1910 році. У статті W. Duke [5] було зазначено, що в пацієнтів із тромбоцитопенією після переливання крові спостерігалося покращення кровотечі, хоча кількість тромбоцитів у них залишалася низькою. Через 50 років A. Hellem і співавт. [6] повідомили про зменшення часу кровотечі за переливання відмитих еритроцитів пацієнтам з анемією та хворим із дефектами кровотечі. Вважалося, що головним чинником у цих випадках є еритроцити. Дослідження C. Ho та співавт. [7] продемонстрували зменшення часу кровотечі після переливання еритроцитів у пацієнтів з анемією та тромбоцитопенією. Ці вчені також повідомили про скорочення часу кровотечі в пацієнтів при залізодефіцитній анемії та збільшення гематокриту після введення заліза [8]. На підставі цих робіт зроблено висновок, що анемія збільшує ризик кровотечі, тоді як еритроцитоз збільшує ризик тромбозу. В разі зниження гематокриту тромбоцити переміщуються ближче до центру судинного просвіту, отже, є менша ймовірність взаємодії з субендотелієм [9, 10]. Гемоглобін також видаляє оксид азоту (NO), отже, зниження гематокриту пов’язуватиметься з підвищеною активністю NO, інгібуванням тромбоцитів і розширенням судин. Окрім того, еритроцити виділяють аденозиндифосфат (АДФ) і тромбоксан А2 (TXA2), які посилюють агрегацію тромбоцитів.
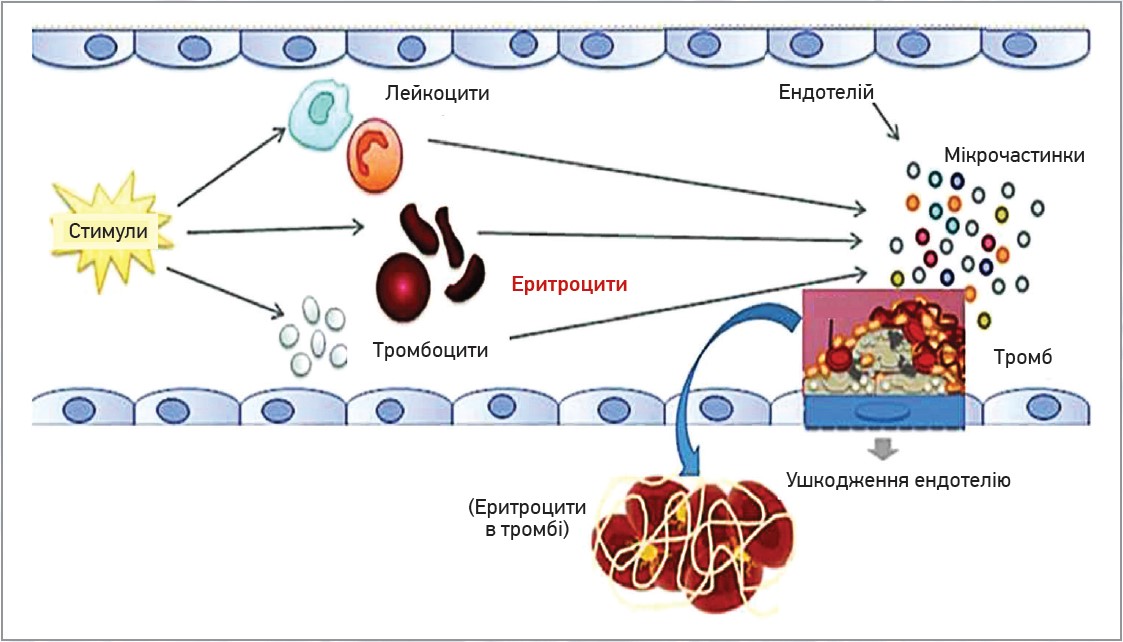
У пацієнтів з істинною поліцитемією кількість еритроцитів значно збільшена (схильність до тромбозу) на відміну від хворих із низьким гематокритом [11, 12]. Також спостерігається підвищення гематокриту, асоційоване з інфарктом мозку та атеросклерозом внутрішніх сонних артерій [13, 14]. З іншого боку, захворювання, які змінюють властивості мембран еритроцитів, можуть зумовити тромбоз. Так, збільшення агрегації еритроцитів пов’язувалося із тромбозом при оклюзії вен сітківки, тромбозі глибоких вен та ішемічній хворобі серця [15-17]. За цих порушень тромбоутворення пов’язувалося з агрегацією еритроцитів, що блокує мікросудинний кровоток. Підвищення гематокриту спричиняє збільшення в’язкості крові, агрегації еритроцитів, стимуляцію та/або зниження деформованості еритроцитів. Підвищення гематокриту сприяє транспорту тромбоцитів і факторів згортання крові до стінки судини, збільшуючи в такий спосіб зіткнення тромбоцитів з активованим ендотелієм та один з одним [18] (рис. 1).
Рис. 1. Рух еритроцитів і тромбоцитів
Примітки: в нормальних умовах еритроцити рухаються в центрі кровотоку, а тромбоцити – ближче до ендотеліальних клітин. Коли гематокрит знижується, тромбоцити переміщуються ближче до центру просвіту судини, отже, з меншою імовірністю взаємодіють із субендотелієм. Після утворення фібринової бляшки еритроцити переплітаються всередині тромбу, стабілізуючи та зміцнюючи його структуру.
Зниження деформованості еритроцитів може сприяти тромбоутворенню за рахунок зміни їхніх властивостей (менше здатні «протискуватися» через вузькі отвори) [19]. Крім того, як було показано, у відповідь на механічну деформацію еритроцити вивільняють аденозинтрифосфат (АТФ) на додаток до АДФ [20, 21].
Серпоподібноклітинна анемія (СКА) – широко відома гемоглобінопатія, за якої знижується деформованість еритроцитів, а утворення тромбіну й активація тромбоцитів збільшуються. Артеріально-венозний тромбоз може виникнути під час вазооклюзійного кризу через СКА. Мембранні білки еритроцитів здатні сприяти розвитку тромботичних епізодів. Прикладом є мікрочастинки (МЧ) – незначні мембранні везикули, що відіграють важливу роль у згортанні крові. Еритроцити та МЧ тромбоцитарного походження можуть ініціювати генерацію тромбіну через фактор XIIa, ймовірно, за допомогою фосфатидилсерин-опосередкованого процесу [22]. Серпоподібні еритроцити не лише виділяють МЧ, а й містять аномальний фосфатидилсерин (ФС) [23].
Збільшення агрегації еритроцитів і патологічний вплив ФС на еритроцити є факторами тромботичних ускладнень за β-таласемії [24, 26]. Крім того, в умовах низьких pO2 та pH, що може спостерігатися при деяких захворюваннях (у т. ч. у разі гемоглобінопатії), АТФ знову секретується еритроцитами. Активовані тромбоцити експресують ФС на своїй поверхні, де локалізуються коагуляційні комплекси (теназа, протромбіназа), а також є первинними поверхнями, на яких відбувається коагуляція [27]. Однак зазвичай частка еритроцитів (0,5%) експресує ФС на своїй поверхні. Отже, навіть незначна частка позитивних ФС еритроцитів здатна відчутно впливати на продукування тромбіну, а також сприяти відкладенню фібрину в разі венозного тромбозу [28, 29].
M. Horne та співавт. досліджували вплив еритроцитів на продукування тромбіну при згортанні крові [30]. Вони не лише виявили, що концентрація тромбіну підвищується зі збільшенням гематокриту (від 10 до 40%), а й відзначили, що максимальна концентрація тромбіну збільшилася, коли лізат еритроцитів змішувався з інтактними еритроцитами чи тромбоцитами. Автори дійшли висновку, що це сталося через мікрочастки з еритроцитів. Вплив інтактних еритроцитів і МЧ на утворення тромбіну, ймовірно, обумовлений наявністю експонованого ФС на їхніх мембранах.
Еритроцити зазвичай не містять ФС на своїй зовнішній мембрані [31], тому необхідний фермент, як-от фосфоліпідна скрамблаза, для переміщення специфічних амінофосфоліпідів на зовнішній бік. За цю транслокацію відповідає механізм, що потребує АТФ і збільшення внутрішньоклітинної концентрації Ca++ в еритроцитах, а це зумовлює активацію скрамблази мембранних фосфоліпідів [32-34]. Фосфоліпідний скрамблінг має стимулювальну роль у генерації МЧ [35]. Протеїнкіназа С в еритроцитах опосередковує фосфорилювання білків цитоскелета, а також відіграє роль у надходженні Ca++ до еритроцитів і подальшому впливі ФС на них [36].
Під час утворення тромбу еритроцити взаємодіють із тромбоцитами, а також посилюють їхню агрегацію. За наявності еритроцитів збільшується кількість вільних жирних кислот, утворюються метаболіти ейкозаноїдів, які продукуються під час активації тромбоцитів [37, 38]. Додавання еритроцитів також посилює дегрануляцію тромбоцитів (АДФ, серотонін, β-тромбоглобулін) та агрегацію під час стимуляції колагеном або тромбіном збагаченої на тромбоцити плазми [39, 42].
Еритроцити включаються в тромби за допомогою специфічних взаємодій під час тромбогенезу, взаємодіють з активованими ендотеліальними клітинами. Цю взаємодію продемонстровано в дослідженні артеріального тромбозу, в якому еритроцити були першими клітинами, що прикріпилися до інтактного ендотелію, обробленого FeCl3, до взаємодії з тромбоцитами, а також опосередковували адгезію тромбоцитів на інтактну ендотеліальну поверхню [43]. Інтегрин-опосередковані взаємодії між еритроцитами, лейкоцитами та тромбоцитами також можуть спричиняти включення еритроцитів у тромби [44]. Еритроцити зв’язуються з рецептором тромбоцитів αIIbβ3 і лігандом молекули внутрішньоклітинної адгезії‑4 (ICAM‑4). Ця взаємодія залежить від стану активації тромбоцитів [45]. ICAM‑4 еритроцитів взаємодіє з лейкоцитарними інтегринами β1 та β2. Зазначено, що еритроцити та фібриноген безпосередньо специфічно взаємодіють один з одним. Два потенційні рецептори на еритроцитах беруть участь у взаємодіях фібриноген – еритроцити: β3 або β3-подібна молекула та інтегрин-асоційований білок CD47 [46, 47]. Фібриноген-опосередкований транспорт фактора XIIIa до згустка необхідний для утримання еритроцитів у тромбах [48, 49]. Червоні кров’яні тільця впливають на структурні та механічні властивості фібрину в тромбі [50]. Виявлено, що взаємодія еритроцитів зі згустками фібрину (червоні тромби) пов’язана з літичною резистентністю тромбів за рахунок підвищеної механічної міцності порівняно зі згустками, що складаються лише із плазми (білі тромби) [51, 52]. При експериментальній ішемії головного мозку під час проведення дослідження показано, що еритроцити всередині тромбу змінюють свою нормальну дискоїдну форму, утворюють виступи, які дозволяють взаємодіяти як один з одним, так і з волокнами фібрину. Дослідники дійшли висновку, що еритроцити можуть переплітатися всередині тромбу для стабілізації та зміцнення його структури.
Позаклітинний (вільний) гемоглобін
У фізіологічних умовах ≈80-90% еритроцитів руйнуються без вивільнення гемоглобіну до плазми в процесі позасудинного гемолізу, а залишок еритроцитів видаляється у фізіологічних умовах у результаті внутрішньосудинного гемолізу чи гемолізу всередині кровоносних судин. У процесі внутрішньосудинного гемолізу гемоглобін викидається безпосередньо до кровотоку, де ця молекула та продукти її деградації можуть спричиняти ушкодження клітин і тканин [55, 56], якщо вони перевищують можливості механізмів, які беруть участь в їхньому видаленні. Вільний гемоглобін у плазмі швидко окислюється до метгемоглобіну, який легко та неферментативно дисоціює на гем і αβ-димери. При низькому вивільненні гемоглобіну в плазмі гаптоглобін (Hp) незворотно пов’язує усі наявні димери αβ-глобіну [57, 58]. Сайти зв’язування Hp розташовані на ланцюгах α-глобіну [59]. Hp синтезується в паренхіматозних клітинах печінки, а період напіввиведення цього глікопротеїну в обіг становить 3,5-5 днів. Однак, якщо він пов’язує димери αβ-глобіну, період напіввиведення такого комплексу потребує усього 9-30 хв. Ці комплекси швидко видаляються із кровообігу шляхом фагоцитозу моноцитів і тканинних макрофагів після зв’язування з ними через CD163-рецептор [60]. Оскільки рециркуляції Hp немає, коли його резерви з обігу вичерпаються, відновлення пулу складає 5-7 днів, оскільки знижується концентрація Hp, проте це не зумовлює збільшення синтезу цієї молекули.
Механізмами, що обмежують ефекти позаклітинного гемоглобіну, крім Hp, є гемопексин і альбумін. Ці дві молекули можуть зв’язувати вільний гем, підтримувати його в розчинній формі, отже, в такий спосіб вони запобігають прояву його окисних та прозапальних властивостей [61]. Гемопексин – гем-зв’язувальний глікопротеїн плазми, що має вищу спорідненість до гему порівняно з усіма відомими гем-зв’язувальними білками. Крім того, гемопексин опосередковує надходження гему до гепатоцитів. Гемопексин синтезується в печінці; в здорових людей період напіврозпаду становить у середньому 7 днів, тоді як у комплексі з гемом період його напіврозпаду скорочується до 7-8 год [62]. Комплекс гем-гемопексин проникає до гепатоцитів за допомогою рецептор-опосередкованого ендоцитозу через ліпопротеїн-рецептор-білок‑1 (LRP), також відомий як CD91. Після ендоцитозу комплекс гем-гемопексин дисоціює, гемопексин вивільняється і повертається до плазми в незміненому вигляді. Транспорт гему до цитоплазми здійснюється внутрішнім гем-зв’язувальним мембранним білком, а залізо швидко видаляється під дією гемоксигенази [63, 64].
Гем також може зв’язуватися з альбуміном у кровотоку й утворювати метальбумін. Видалення метальбуміну із кровообігу є кінетично складним процесом. Попередні дослідження показали, що гем плазми може також пов’язувати α1-мікроглобулін (А1М), глікопротеїн масою 26 кДа, який синтезується в печінці, секретується в кров. Цей білок має редуктазну активність, запобігає внутрішньоклітинному окисленню та знижує експресію гем-індукованої гемоксигенази‑1 (HO‑1), продукцію активних форм кисню за рахунок наявності гемоглобіну в позаклітинному середовищі [65-67]. Нові дані передбачають використання апогемоглобіну чи апогемоглобіну-Hp як нової терапевтичної стратегії з очищення та виведення надлишку гему через поверхневий рецептор CD163 моноцитів/макрофагів [68].
Механізм дії позаклітинного гемоглобіну
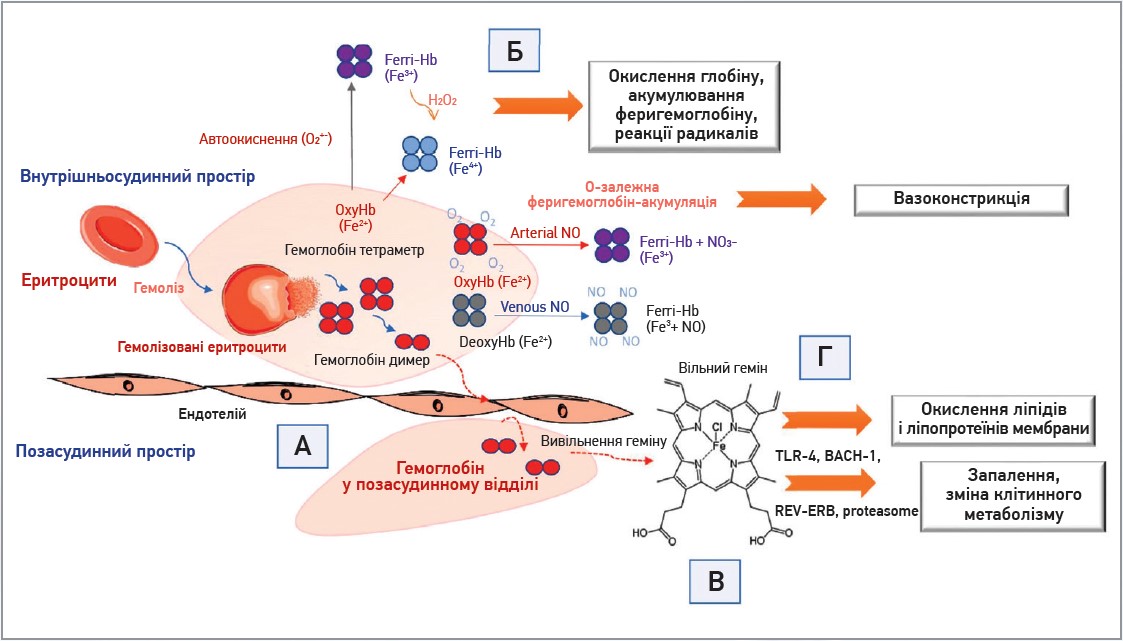
Якщо позаклітинний гемоглобін перевищує гомеостатичні механізми його видалення при внутрішньосудинному гемолізі, він може вплинути на навколишні клітини та тканини. Різні клінічні аспекти, пов’язані з надлишком циркулювального позаклітинного гемоглобіну, пояснено на підставі специфічних структурних і біохімічних характеристик молекули гемоглобіну за допомогою 4 запропонованих механізмів взаємодії. Першим є позасудинна транслокація гемоглобіну [69] (рис. 2).
Рис. 2. Механізми дії ендогенного позаклітинного гемоглобіну
Примітки: A) позасудинна транслокація гемоглобіну; Б) прооксидативна реактивність гемоглобіну в плазмі чи всередині тканин після екстравазації; В) вивільнення геміну з Hb-Fe3+ як основного продукту окисних реакцій; Г) індуковані геміном зміни в активації клітин, експресія генів і метаболізм.
Після гемолізу еритроцитів гемоглобін існує у динамічній рівновазі тетрамерів та αβ-гетеродимерів. Гетеродимери відносно малі, здатні до транслокації та доступу до уразливих анатомічних ділянок, наприклад клубочків нирок або судинної стінки. Вплив гемоглобіну на тканини найчастіше супроводжується випадками надмірної гемоглобінурії після масивного внутрішньосудинного гемолізу. Гемоглобін може також переміщатися через ендотеліальні бар’єри, отже, проникати в такий спосіб до субендотеліального та периваскулярного простору, лімфи [70, 71].
Інший механізм дії позаклітинного гемоглобіну – прооксидативна реактивність гемоглобіну в плазмі чи всередині тканин після екстравазації. Найвивченішими реакціями гемоглобіну є такі з NO та фізіологічними оксидантами (перекисом водню, пероксидами ліпідів). Споживання NO, подальше окислення гемоглобіну відбуваються за допомогою двох реакцій: NO-діоксигенування оксигемоглобіну з генеруванням нітратів (NO3–), а також феригемоглобіну (Hb-Fe3+) нітрозилюванням дезоксигемоглобіном заліза, яке відбувається за прямого зв’язування NO із залізом феригемоглобіну (Hb-Fe2+) [72, 73]. Зв’язування NO позаклітинним гемоглобіном зумовлює виснаження цього важливого вазодилататора, який виробляється в ендотелії судин, що є причиною гіпертонії. Ще один запропонований механізм дії позаклітинного гемоглобіну – вивільнення геміну з Hb-Fe3+ як основного продукту окисних реакцій. Виділення геміну дозволяє перенести реактивний порфірин на клітинну мембрану або розчинні білки плазми й ліпіди, а також забезпечує вільний гемін як ліганд для різних сигнальних шляхів. Оскільки гемін є гідрофобною молекулою, малоймовірно, що більші кількості вільного геміну будуть виявлені в плазмі. Він швидко зв’язується з альбуміном або ліпідами й утворює комплекси. Залежно від того, із чим він зв’язується, гемін може перетворити молекулу з комплексу на реакційний продукт, як-от окислені ліпопротеїни низької щільності, що ще більше ушкоджує судинну мережу [74, 75]. Ще один механізм належить до ефектів, що здійснюється геміном. Гемін здатен вибірково зв’язуватися з декількома рецепторами та факторами транскрипції, а також спричинити активацію клітин, експресію генів тощо.
Позаклітинний гемоглобін і тромбоз
З’являється дедалі більше доказів, що підтверджують пряму кореляцію між підвищеними рівнями позаклітинного гемоглобіну та тромботичними ускладненнями, пов’язаними з гемолізом [76-79]. Однак точні молекулярні механізми, які запускають тромбоз, індукований позаклітинним гемоглобіном, досі недостатньо вивчені. Гемоглобін зазвичай міститься в еритроцитах, що переносять кисень, але при гемолітичних захворюваннях, як-от СКА, або під час механічного гемолізу гемоглобін вивільняється до кровотоку. Тривалість життя позаклітинного гемоглобіну зазвичай коротка через його швидкий кліренс «білком-сміттярем» гаптоглобіном, але безперервний гемоліз може зумовити накопичення позаклітинного гемоглобіну в плазмі. Хоча гемоглобін не взаємодіє безпосередньо із тромбоцитами, високі рівні позаклітинного гемоглобіну здатні збільшувати споживання NO судинами, що спричиняє ушкодження ендотелію, активацію тромбоцитів [80-83].
Нещодавні дослідження показали, що гемоглобін також може зв’язуватися із фактором фон Віллебранда (ФВ), глікопротеїном плазми, який ініціює активацію тромбоцитів у відповідь на ушкодження судин [84-86]. Було висловлено припущення, що комплекс гемоглобін/ФВ здатен мати підвищену гемостатичну активність порівняно з одним лише ФВ, а зв’язування позаклітинного гемоглобіну із ФВ зумовлює стимуляцію тромбоутворення. Однак структурна основа того, як гемоглобін зв’язується із ФВ і як ця взаємодія посилює гемостатичну активність ФВ, залишається незрозумілою.
Ключовою особливістю регулювання гемостатичної активності ФВ є вплив на його домен A1. Пептидні ділянки, як-от автоінгібувальний модуль (AIM), відіграють значну роль у модуляції впливу А1 [87, 88]. AIM маскує домен A1 ФВ у ділянках, включаючи спіраль α1 та петлі α1-β2, β3-α2. Розархівування AIM від A1 необхідне для взаємодії між A1 і GPIbα тромбоцитів, яка вважається початковим кроком активації тромбоцитів, опосередкованої ФВ. Рекомбінантні фрагменти А1, що несуть AIM, чинять набагато меншу активність, ніж фрагменти без AIM. У попередніх дослідженнях повідомлялося про взаємодію гемоглобіну із фрагментом А1, що несе AIM. Однак зв’язування гемоглобіну із фрагментом А1, позбавленим AIM, не досліджувалося.
Пристрої для механічної підтримки кровообігу та вільний гемоглобін
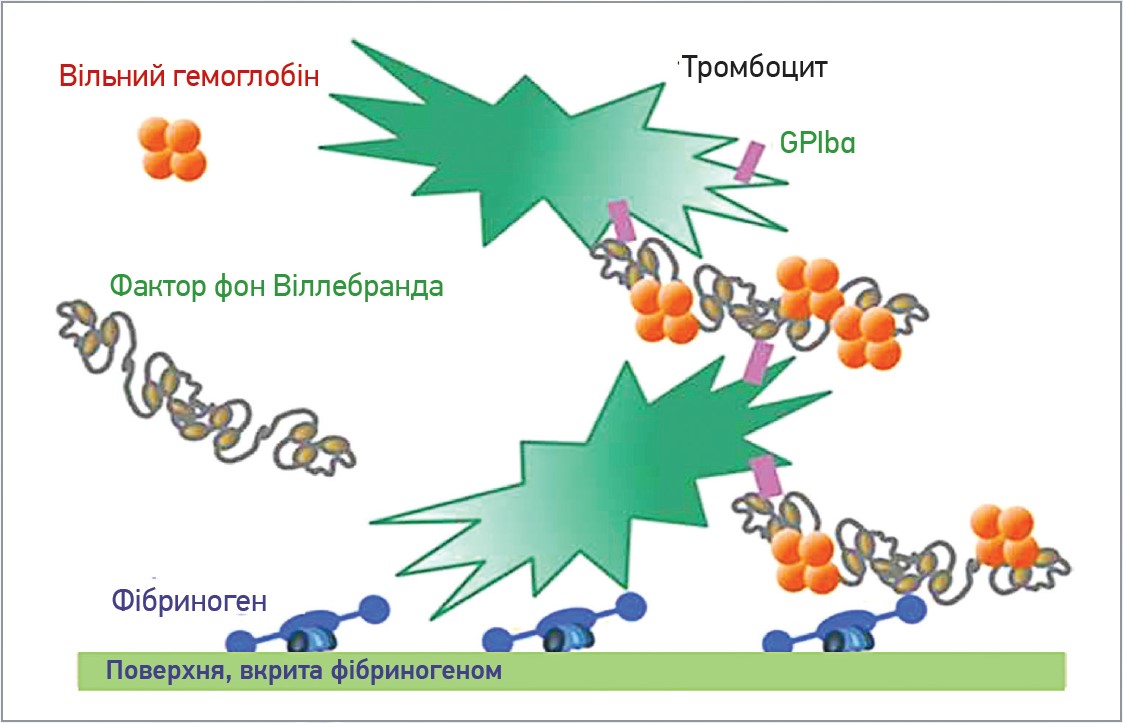
В умовах високої напруги зсуву, характерного для пристроїв механічної підтримки кровообігу, вільний гемоглобін зв’язується із ФВ, збільшує спорідненість мультимерів ФВ до рецептора GPIb на поверхні тромбоцитів. Ця взаємодія дозволяє тромбоцитам зв’язуватися з поверхнями, вкритими фібриногеном. Оскільки в пацієнтів з апаратами механічної підтримки кровообігу рівень вільного гемоглобіну в крові підвищений унаслідок гемодинамічних порушень взаємодії між вільним гемоглобіном і фактором фон Віллебранда, це може сприяти розвитку тромбів за рахунок посилення зв’язування та агрегації тромбоцитів на поверхні пристрою підтримки кровообігу, вкритого адсорбованим фібриногеном (рис. 3).
Рис. 3. Зв’язування вільного гемоглобіну із фактором фон Віллебранда, що збільшує спорідненість мультимерів до рецептора GPIbα на поверхні тромбоцитів
Висновки
- Еритроцити сприяють тромбоутворенню за рахунок ефекту в’язкості, беруть участь в агрегації тромбоцитів, експресують ФС і МЧ.
- Червоні кров’яні тільця взаємодіють із тромбоцитами, ендотеліальними клітинами та фібриногеном, що зумовлює їхнє включення до тромбів.
- Переплетення еритроцитів усередині тромбу стабілізує та зміцнює його структуру, зменшує фібриноліз, а також є важливим доповненням складних реакцій утворення тромбів.
- Наявні нові дані про підвищений рівень позаклітинного гемоглобіну та тромботичні ускладнення, пов’язані з гемолізом. Взаємозв’язок між гемолізом і тромбозом є складним, має безліч факторів, як-от активація тромбоцитів, ФВ та медіатори запалення.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 3 (564), 2024
СТАТТІ ЗА ТЕМОЮ Діагностика
У сучасному світі онкологічні захворювання становлять чи не найбільшу загрозу життю людини, поступаючись тільки серцево-судинній патології [1]. Більшість неінфекційних хвороб людини, зокрема й онкологічні захворювання, є багатофакторними, і їх розвиток пов’язаний у тому числі з генетичними чинниками. Це, з одного боку, підвищує з віком ризик виникнення хронічних захворювань, а з іншого – дає змогу разом з лікарем розробити заходи з їх профілактики, раннього виявлення й ефективного лікування [2]....
Власна патоморфологічна лабораторія – необхідність для всіх клінік ендоскопічного, хірургічного й онкологічного профілю. Одним із видів діяльності такої лабораторії є проведення інтраопераційних досліджень. Ці дослідження виконують для визначення тактики подальшого оперативного втручання під час операції. Тому створення лабораторії на колесах, що може надавати результати патоморфологічного дослідження в будь-якому місці та ще під час операційного втручання, стало логічним рішенням для Медичної лабораторії CSD LAB, найбільшої патоморфологічної лабораторії України та Східної Європи....
Нефракціоновані (НФГ) і низькомолекулярні гепарини (НМГ) є препаратами, що широко використовуються та запобігають артеріальним і венозним тромбозам. Однак їхнє застосування також пов’язано з парадоксальною реакцією, що зумовлює потенційно небезпечний для життя протромботичний стан, результатом чого є серйозні ускладнення (гангрена, ампутація кінцівок) або фатальні наслідки. Гепарин-індукована тромбоцитопенія (ГІТ) – це імуноопосередкована відповідь на введення гепарину, який спричиняє небезпечний для життя тромбоз і є клінічно значущим негеморагічним ускладненням. ГІТ вважається потенційно загрозливим для життя станом за терапії гепарином, що спричиняє утворення нових згустків крові, а не сприяє запобіганню утворення нових тромбів. Хоча при введенні гепарину імунна реакція зустрічається досить часто (від 8 до 50%), клінічні ускладнення у разі ГІТ виникають у ≈0,2-3% пацієнтів, які приймають гепарин протягом >4 дні; частіше спостерігаються в жінок [1-3]. У цьому стані тромбоцити різко знижуються до рівня ≥20×109/л. Смертність становить 10-20%....
Протягом останіх десятиліть значної актуальності набула проблема резистентності до протимікробних препаратів (РПП). Всесвітня організація охорони здоров’я оголосила, що РПП є однією з десяти найбільших глобальних загроз громадському здоров’ю, з якими стикається людство....