Гепатоцелюлярна карцинома
Стандарт медичної допомоги
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома».
Загальна частина
Назва діагнозу: гепатоцелюлярна карцинома.
Коди стану або захворювання.
НК 025: 2021. «Класифікатор хвороб та споріднених проблем охорони здоров’я»:
С 22. Злоякісне новоутворення печінки і внутрішньопечінкових жовчних проток.
Розділ I. Організація надання медичної допомоги пацієнтам із ГЦК
Положення стандарту медичної допомоги. Медичною допомогою пацієнти з ГЦК забезпечуються у закладах охорони здоров’я (ЗОЗ), що надають спеціалізовану медичну допомогу.
Лікарі різних спеціальностей мають бути обізнані щодо основних факторів ризику і клінічних проявів онкологічних захворювань з метою раннього виявлення і направлення пацієнта до відповідного ЗОЗ.
Обґрунтування. Ефективна взаємодія між учасниками процесу вважається найкращою практикою лікування, а також невід’ємною складовою скоординованої допомоги в онкології.
Заходи з раннього (своєчасного) виявлення цього виду злоякісних пухлин дозволяють істотно поліпшити стан пацієнта.
Критерії якості медичної допомоги
Обов’язкові
- Пацієнти з підозрою на ГЦК з метою встановлення діагнозу і призначення лікування направляються до ЗОЗ, що надає спеціалізовану медичну допомогу пацієнтам із ГЦК.
- Існують локально узгоджені письмові документи, що координують та інтегрують медичну допомогу для забезпечення діагностики і лікування пацієнтів із ГЦК.
- Забезпечення пацієнтам із прогресуючим захворюванням після завершення спеціального лікування адекватного знеболення, проведення інших заходів з паліативної допомоги, а також симптоматичного лікування відповідно до галузевих стандартів у сфері охорони здоров’я.
- Пацієнти і, за згодою, члени сім’ї/особи, які здійснюють догляд, забезпечуються у доступній формі інформацією щодо стану пацієнта, плану обстеження, лікування і подальшого спостереження.
Бажані
Надання інформації пацієнтам, які перенесли спеціальне протипухлинне лікування, щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень у зв’язку з високою небезпекою виникнення рецидиву або іншої пухлини, а також рекомендацій щодо способу життя, режиму харчування і фізичних навантажень.
Розділ II. Діагностика ГЦК
Положення стандарту медичної допомоги. Діагноз ГЦК встановлюється у ЗОЗ, що надають спеціалізовану медичну допомогу, на основі збору анамнестичних даних, фізикального обстеження, лабораторних, радіологічних методів дослідження (рис. 1) і за результатами морфологічного дослідження біопсії пухлинного утворення (панель 1).
Панель 1
Принципи товстоголкової біопсії
1. Ініціальна товстоголкова біопсія
- Новоутворення високопідозріле як злоякісне за даними мультифазної КТ або МРТ, але не відповідає візуалізаційним критеріям ГЦК.
- Новоутворення відповідає критеріям візуалізації ГЦК, але:
- пацієнт не належить до групи високого ризику виникнення ГЦК (у нього немає цирозу, хронічного гепатиту B, поточного або попереднього вірусного гепатиту C);
- у пацієнта наявний цироз серцевого походження, вроджений фіброз печінки або цироз через судинні хвороби, такі як синром Бадда – Кіарі, спадкова геморагічна телеангіектазія або нодулярна регенеративна гіперплазія;
- у пацієнта підвищений рівень CA19-9 або ракового ембріонального антигену із підозрою на внутрішньопечінкову холангіокарциному або змішану гепатоцелюлярну холангіоцелюлярну карциному.
- Підтвердження метастатичного захворювання може змінити тактику лікування включно із клінічним дослідженням.
- Рішення щодо хірургічної резекції без товстоголкової біопсії має бути прийняте на мультидисциплінарному консиліумі.
2. Якщо прийняте рішення щодо товстоголкової біопсії, вона має бути виконана до абляції.
3. Повторна товстоголкова біопсія:
- недіагностична товстоголкова біопсія;
- попередня біопсія не корелює із даними візуалізаційних обстежень, біомаркерами чи іншими факторами.
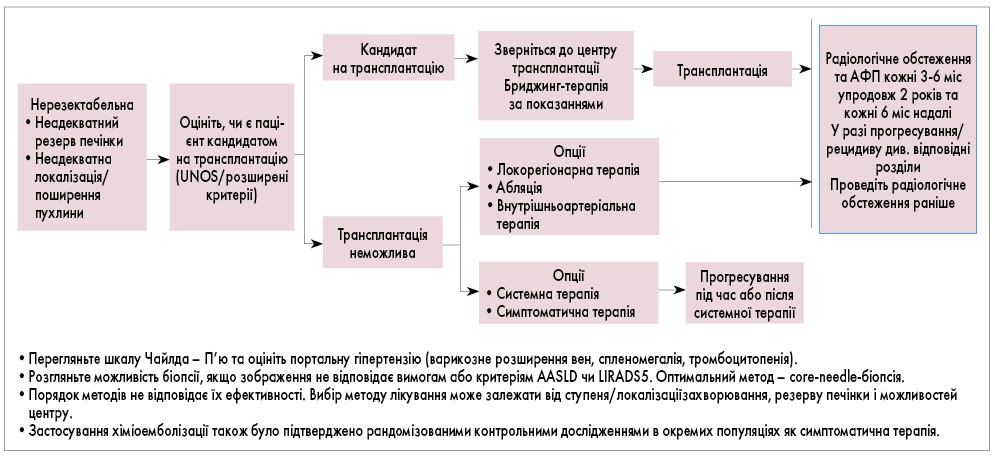 Рис. 1. Алгоритм досліджень для встановлення діагнозу ГЦК
Рис. 1. Алгоритм досліджень для встановлення діагнозу ГЦК
При складанні плану лікування пацієнтам, яким встановлено діагноз ГЦК, призначають додаткові дослідження, проводять періопераційну підготовку, визначають прогноз захворювання.
Обґрунтування. ГЦК – первинне злоякісне новоутворення печінки, яке характеризується виникненням у паренхімі солідних пухлинних вогнищ, що походять із гепатоцитів. Основними факторами ризику розвитку ГЦК є цироз і хронічні захворювання печінки незалежно від етіології. Причинами розвитку ГЦК можуть стати вірусні гепатити В і С, алкогольна хвороба печінки, первинний гемохроматоз, неалкогольна жирова хвороба печінки (НАЖХП), первинний біліарний холангіт (IV стадія), дефіцит альфа-1-антитрипсину, пізня шкірна порфірія, хвороба Вільсона, вірус імунодефіциту людини, відносно рідко – спадкові порушення метаболізму. Перебіг ГЦК може бути безсимптомним упродовж тривалого часу, а паранеопластичні синдроми рідко проявляються і включають гіперхолестеринемію, еритроцитоз, гіперкальціємію та гіпоглікемію.
Первинне обстеження пацієнтів із підозрою на ГЦК передбачає мультидисциплінарну оцінку, включаючи дослідження етіологічного походження захворювання печінки, панель гепатитів для виявлення вірусної інфекції гепатиту B і С, оцінку наявності супутніх захворювань, оцінку функції печінки, у тому числі виявлення портальної гіпертензії, а також наявність метастатичного захворювання.
Радіологічне обстеження ГЦК передбачає використання мультифазного протоколу комп’ютерної томографії (КТ) печінки із внутрішньовенним контрастуванням (передконтрастна, нативна, артеріальна, портальна венозна фази, delayed) або магнітно-резонансної томографії (МРТ) із внутрішньовенним контрастним підсиленням.
Ультразвукове дослідження (УЗД) із контрастним підсиленням (CEUS) може застосовуватися як інструмент для оцінки неоднозначних вузлів; не рекомендується його використання для оцінки стану всієї печінки, спостереження або стадіювання.
Для пацієнтів із підозрою на ГЦК, а також пацієнтів із випадково виявленими печінковою масою або вузлом на УЗД або іншому зображенні рекомендується оцінка за допомогою мультифазної КТ черевної порожнини з контрастним підсиленням або МРТ (бажано з використанням контрасту на основі гадолінію) з метою визначення розміру і кількості утворень, судинної анатомії та позапечінкової патології. Якщо під час мультифазного обстеження з контрастним підсиленням не виявлено пухлини або виявлене утворення однозначно є доброякісним, то пацієнти мають перебувати під спостереженням (УЗД та визначення альфа-фетопротеїну — АФП – через 6 міс).
Молекулярна діагностика передбачає визначення сироваткового рівня АФП, хоча воно не є чутливим або специфічним діагностичним тестом для ГЦК, оскільки рівень сироваткового АФП може бути підвищений в осіб із деякими незлоякісними захворюваннями, такими як хронічний вірусний гепатит В і С, або перебувати в межах норми у 30% пацієнтів із ГЦК. Рекомендується проведення додаткових візуальних обстежень (КТ або МРТ) у пацієнтів із підвищеним рівнем сироваткового АФП без наявності пухлини в печінці.
Первинна трепанобіопсія підозрюваної ГЦК може розглядатися у випадках, коли результати мультифазної КТ або МРТ не відповідають критеріям зображення для ГЦК. Первинна трепанобіопсія може виконуватися пацієнтам, які не належать до групи високого ризику розвитку ГЦК; пацієнтам із захворюваннями, що супроводжують формування незлоякісних вузлів (кардіальний цироз, вроджений печінковий фіброз або цироз, пов’язаний із судинними порушеннями, такими як синдром Бадда – Кіарі, спадкова геморагічна телеангіоектазія або вузлова регенеративна гіперплазія печінки); у пацієнтів із підвищеним рівнем СА19-9 або ракового ембріонального антигену. Якщо розглядається проведення трепанобіопсії, її слід виконати до абляції.
Основними локалізаціями метастазів ГЦК є легені, надниркові залози, очеревина та кістки, тому рекомендується проведення КТ грудної клітки, за необхідності – остеосцинтиграфії та/або додаткових обстежень кісток; мультифазну контрастну КТ або КТ/МРТ черевної порожнини, КТ/МРТ таза. Збільшені лімфатичні вузли часто спостерігаються у пацієнтів із вірусними гепатитами, первинним жовчним цирозом та іншими захворюваннями печінки, що сприяють розвитку ГЦК. Виявлення захворювання з лімфатичним метастатичним ураженням за допомогою перехресного зображення є неспецифічним.
Початкова оцінка функції печінки включає вимірювання рівня білірубіну, аспартатамінотрансферази (АСТ), аланінтрансамінази (АЛТ), лужної фосфатази (ЛФ), визначення протромбінового часу (ПТЧ) у вигляді міжнародного нормалізованого відношення (МНВ), альбуміну та рівня тромбоцитів (корелюючого для портальної гіпертензії). Інші рекомендовані тести включають загальний клінічний аналіз крові (ЗАК), азот сечовини і креатинін для оцінки функції нирок; креатинін також є встановленим прогностичним маркером у пацієнтів із захворюванням печінки. Додаткова оцінка функціональної резервної здатності печінки перед її резекцією у пацієнтів із цирозом може проводитися за допомогою різних інструментів, таких як ультразвукова та МРТ-еластографія (які можуть забезпечувати і кількісно оцінювати ступінь фіброзу, пов’язаного з цирозом), нефокальна печінкова біопсія та транс’югулярна біопсія печінки з вимірюванням тиску.
Ознаки портальної гіпертензії можуть бути оцінені за допомогою КТ/МРТ, езофагогастродуоденоскопії або контрастно підсиленого крос-секційного зображення.
Для оцінки функціональної резервної здатності печінки у пацієнтів із цирозом використовується класифікація за шкалою Чайлда – П’ю (табл.).
|
Таблиця. Шкала Чайлда – П’ю |
|||
|
Хімічні та біохімічні параметри |
Бали, що відповідають збільшенню аномалії |
||
|
1 |
2 |
3 |
|
|
Енцефалопатія (ступінь) |
Відсутній |
12 |
34 |
|
Асцит |
Відсутній |
Незначний |
Помірний |
|
Альбумін (г/дл) |
>3,5 |
2,83,5 |
<2,8 |
|
Протромбіновий час Секунд більше норми МНВ |
<4 <1,7 |
46 1,72,3 |
>6 >2,3 |
|
Білірубін (мг/дл) Для пацієнтів із первинним біліарним цирозом |
<2 <4 |
23 410 |
>3 >10 |
|
Клас A=56 балів; клас B=79 балів; клас C=1015 балів. Клас A: низький оперативний ризик. Клас B: помірний оперативний ризик. Клас C: високий оперативний ризик. |
|||
Критерії якості медичної допомоги
Обов’язкові
- Діагностичні заходи при первинному обстеженні пацієнтів із підозрою на ГЦК передбачають збір анамнестичних даних, фізикальне обстеження, спрямоване на виявлення неспецифічних ознак ГЦК (жовтяниці, апатії, втрати маси тіла, загальної слабкості та болю у верхній частині живота, гепатомегалії, асциту), наявність супутніх захворювань.
- З метою встановлення етіології захворювання печінки призначають дослідження для виявлення вірусної інфекції гепатиту B і/або С. Панель гепатитів включає визначення:
- поверхневого антигену гепатиту В (HBsAg). Якщо він позитивний, необхідно перевірити е-антиген гепатиту B, e-антитіла до гепатиту B і кількісну ДНК вірусу гепатиту B; пацієнт має бути направлений до фахівця із захворювань печінки;
- поверхневих антитіл до гепатиту В (лише для оцінки вакцини). Антитіла до ядерного антигену гепатиту B (HBcAb) IgG, HBcAb IgM слід перевіряти лише у випадках гострого вірусного гепатиту. Ізольований HBcAb IgG може бути хронічним HBV і має спонукати до кількісного визначення ДНК вірусу гепатиту B;
- антитіл до гепатиту С. У разі позитивного результату необхідно перевірити кількісну РНК вірусу гепатиту C і його генотип, а пацієнт має бути направлений до фахівця із захворювань печінки.
3. Початкова оцінка функції печінки передбачає вимірювання рівнів білірубіну, АСТ, АЛТ, ЛФ, визначення ПТЧ у вигляді МНВ, альбуміну та рівня тромбоцитів (корелюючого для портальної гіпертензії), ЗАК, азоту сечовини та креатиніну для оцінки функції нирок.
4. Рекомендовано після позитивного результату скринінгу або контрольного обстеження пролікованого пацієнта виконати багатофазну КТ або МРТ із внутрішньовенним контрастуванням з метою підтвердження діагнозу і визначення стадії захворювання.
5. Передопераційна візуалізація ГЦК здійснюється за допомогою КТ або МРТ із внутрішньовенним контрастуванням.
6. Для виявлення метастатичної хвороби та оцінки функції печінки, включаючи визначення наявності портальної гіпертензії (наприклад, варикозно розширені вени, спленомегалія, тромбоцитопенія), призначаються візуальні та лабораторні дослідження: УЗД-еластографія печінки та селезінки, езофагогастроскопія (виявлення варикозно змінених вен стравоходу), КТ, МРТ, визначення рівня АФП у сироватці крові.
7. Діагноз ГЦК у пацієнтів із виявленими факторами ризику ГЦК може бути встановлений неінвазивним способом за допомогою радіологічних методів (МРТ і КТ) на основі діагностичних зображень при мультифазовому зображенні.
8. Пацієнтам зі встановленими факторами ризику розвитку ГЦК необхідно проводити спостережні обстеження з використанням УЗД і вимірюванням рівня АФП (кожні 6 місяців). У разі зростання рівня АФП або виявлення пухлинного вузла печінки розміром ≥10 мм на УЗД проводиться додаткове обстеження з використанням абдомінальної мультиспіральної КТ або МРТ.
9. Діагноз ГЦК можна встановити без товстоголкової біопсії методом контрастно підсиленої МРТ для печінкових вузлів розміром 2 см або менше, виявлених при УЗД за критеріями Liver Imaging Reporting and Data System (LIRADS).
10. Ураження, які не відповідають критеріям радіологічної візуалізації, описаним вище для ГЦК, потребують індивідуального обстеження, яке може включати додаткову візуалізацію (КТ/МРТ) або товстоголкову біопсію після міждисциплінарного обговорення і відповідно до алгоритмів лікування (рис. 2, 3).
11. Якщо результати обстеження неоднозначні щодо наявності ГЦК або доброякісності процесу, надаються рекомендації стосовно проведення індивідуального обстеження, включаючи додаткові методи візуалізації або біопсію.
12. Пацієнтам, у яких виявлено новоутворення печінки, але відсутній високий ризик розвитку ГЦК, слід запропонувати провести трепанобіопсію новоутворення.
 Рис. 2. Алгоритм спостереження за хворими з нерезектабельною ГЦК
Рис. 2. Алгоритм спостереження за хворими з нерезектабельною ГЦК
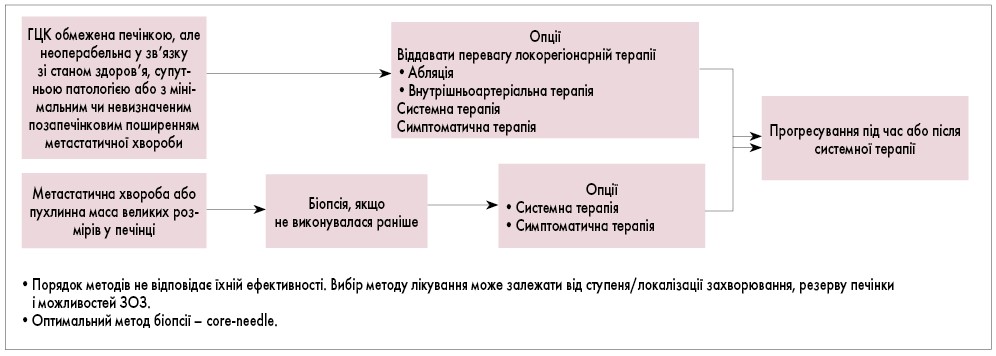
Рис. 3. Алгоритм лікування при неоперабельній ГЦК і метастазах
Бажані
- За необхідності рекомендовано виконання CEUS і визначення рівня сироваткових маркерів: АФП, лінзового аглютинін-реактивного АФП (AFP-L3), дес-гамма-карбоксипротромбіну (DCP).
- Пацієнтам, у яких підтверджено ГЦК, з метою прогнозування перебігу захворювання проводиться позитронно-емісійна томографія з КТ (ПЕТ-КТ).
Розділ III. Лікування пацієнтів із ГЦК
Положення стандарту медичної допомоги. Спеціальне протипухлинне лікування пацієнтів із ГЦК здійснюється виключно у ЗОЗ, що надають спеціалізовану медичну допомогу.
Для вибору найбільш оптимальної та ефективної стратегії лікування, за якої можна досягти найкращого прогнозу захворювання зі збереженою якістю життя, ведення пацієнтів із ГЦК передбачає мультидисциплінарний підхід. План лікування пацієнта з ГЦК, складений консиліумом фахівців і погоджений з пацієнтом, має враховувати стадію захворювання, швидкість росту пухлини, функцію печінки, загальний стан пацієнта.
Лікування ГЦК передбачає застосування хірургічних методів (резекції, трансплантації печінки), локорегіонарних методів (абляції та внутрішньоартеріальної селективної хіміотерапії), системної терапії.
Обґрунтування. Лікування ГЦК часто ускладнюється наявністю супутніх захворювань печінки. Крім того, різна етіологія ГЦК та її дія на печінку можуть впливати на ефективність лікування. Супутня патологія (цироз, гостре пошкодження нирок, портальна гіпертензія, гострі вірусні гепатити, імунодефіцитні стани тощо) впливає на вибір методу лікування у пацієнтів із ГЦК і потребує мультидисциплінарного підходу. При виборі методу лікування мають бути враховані ризики можливих токсичних ефектів від лікування і потенційні переваги.
Противірусна терапія гепатитів В і С у пацієнтів із ГЦК може розглядатися як передумова для безпечного та ефективного лікування ГЦК. Терміни призначення противірусної терапії залежать від стадії ГЦК, визначення її резектабельності і можливості проведення трансплантації печінки. Рішення щодо необхідності лікування, термінів його початку і тривалості приймається в кожному окремому випадку шляхом міждисциплінарного обговорення із залученням лікаря-інфекціоніста згідно з галузевими стандартами медичної допомоги при вірусних гепатитах В і С.
Резекція печінки є лікувальним методом у пацієнтів із одиночною пухлиною будь-якого розміру без ознак макроваскулярної інвазії при ГЦК. Вона може виконуватися з низькими показниками рівня післяопераційних ускладнень і смертності. Оскільки резекція печінки у пацієнтів із ГЦК включає видалення функціональної паренхіми на тлі наявного супутнього захворювання органа, ретельний відбір пацієнтів базується на характеристиках пацієнта, а також показниках печінки і пухлини/пухлин. Необхідно враховувати загальний соматичний стан пацієнта і наявність супутньої патології, яка є незалежним прогностичним фактором періопераційної летальності. Також потрібно враховувати функціональну здатність печінки, об’єм перспективного залишку печінки, технічні аспекти, пов’язані з пухлиною та індивідуальними анатомічними особливостями печінки, до прийняття рішення щодо її резекції.
Резекція печінки є методом вибору, якщо у пацієнта:
- функція печінки адекватна (клас А за шкалою Чайлда – П’ю без портальної гіпертензії);
- майбутній залишковий об’єм печінки – принаймні 20% у пацієнтів без цирозу, принаймні 30-40% у пацієнтів із класом А за шкалою Чайлда – П’ю, можливість збереження адекватного притоку/відтоку крові та жовчі.
Резекція може бути проведена, якщо багатовогнищеве ураження обмежене та резектабельне, а також при інвазії великих судин.
Для пацієнтів із хронічним захворюванням печінки, для яких заплановано проведення резекції, має бути розглянута передопераційна емболізація портальної вени.
Для деяких пацієнтів із первинно нерезектабельним захворюванням та досягнутою відповіддю на терапію можна розглянути можливість проведення хірургічного втручання після завершення системної терапії.
Для пацієнтів із класом А за шкалою Чайлда – П’ю, які відповідають критеріям трансплантації та в яких пухлина резектабельна, можна розглянути як проведення резекції, так і трансплантації. Літні пацієнти можуть отримати користь від резекції печінки або трансплантації при ГЦК, але вони потребують ретельного відбору, оскільки загальна виживаність у них нижча, ніж молодих пацієнтів.
Трансплантація печінки також є методом лікування для пацієнтів із ранньою формою ГЦК і помірним чи тяжким цирозом, який має істотну перевагу, оскільки видаляються як ідентифіковані, так і невиявлені пухлинні ураження, усувається цироз печінки, що лежить в основі розвитку ГЦК, а також уникаються хірургічні ускладнення, пов’язані з недостатнім об’ємом перспективного залишку печінки. Після виконаної трансплантації також існує ризик потенційних ускладнень, таких як рання смертність і проблеми, пов’язані з хронічною імуносупресією.
Локорегіонарні методи, які включають абляцію та внутрішньоартеріальну терапію, рекомендуються при одиничних пухлинах у неоперабельних пацієнтів або при множинних пухлинах та є альтернативою резекції або трансплантації печінки; внутрішньоартеріальна терапія може бути «містком» до трансплантації печінки для пацієнтів у листі очікування.
Для пацієнтів із поширеною стадією захворювання і прогресуючим захворюванням методом лікування є системна терапія.
Критерії якості медичної допомоги
Обов’язкові
- З метою визначення стратегії лікування проводиться оцінка резектабельності пухлини згідно з алгоритмом (рис. 4).
- Пацієнти з ГЦК і цирозом печінки розглядаються як потенційні кандидати на трансплантацію печінки відповідно до алгоритму на рисунку 5.
- Резекційна хірургія печінки як радикальний метод лікування онкологічного захворювання рекомендована пацієнтам з одиничною пухлиною або 3 пухлинами із максимальним діаметром до 3 см без вираженої макроваскулярної інвазії у разі наявності цирозу печінки (ступінь вираженості цирозу A за шкалою Чайлда – П’ю) і відсутності проявів портальної гіпертензії.
- У разі нерезектабельності пухлини, наявності метастазів лікування здійснюється за алгоритмами (рис. 2, 3).
- Системна терапія (панель 2) є методом лікування пацієнтів із поширеною пухлиною (метастатичною хворобою/місцевим поширенням). Як першу лінію терапії рекомендовано застосувавати комбінацію атезолізумабу і бевацизумабу.
- Для прогресуючого захворювання після системної терапії першої лінії рекомендується декілька варіантів терапії наступної лінії, які включають регорафеніб, кабозантиніб і рамуцирумаб. Регорафеніб і кабозантиніб рекомендовані лише пацієнтам із функцією печінки A за шкалою Чайлда – П’ю, тоді як рамуцирумаб – лише пацієнтам із початковим рівнем АФП 400 нг/мл або вище і функцією печінки A за шкалою Чайлда – П’ю.
- Для всіх пацієнтів із пізніми стадіями ГЦК, які отримували системну терапію, рекомендовано проводити періодичну оцінку ефективності лікування з поперечним зображенням ділянок ризику метастатичного прогресування, включаючи грудну клітку, черевну порожнину і таз.
- Пацієнтам із вперше встановленим діагнозом ГЦК із новоутвореннями гепатопанкреатобіліарної зони рекомендовано направлення до ЗОЗ, що надають спеціалізовану медичну допомогу і мають досвід лікування пацієнтів з цією патологією.
- Внутрішньоартеріальна терапія рекомендована пацієнтам із множинними вогнищами пухлини, які не є кандидатами на резекцію або трансплантацію печінки. Усі ГЦК, незалежно від розташування в печінці, можуть піддаватися внутрішньоартеріальним методам лікування за умови, що артеріальне кровопостачання пухлини є ізольованим. Основні принципи локорегіонарних методів лікування наведені на панелі 3.
- Абляція є варіантом лікування ретельно відібраних пацієнтів із пухлинами ГЦК ≤2 см у діаметрі, локалізованими в доступному місці і віддаленими від основних судинних, жовчних структур і суміжних органів. Пухлини розміром від 3 до 5 см можна лікувати комбінацією мікрохвильової абляції та/або внутрішньоартеріальної терапії, якщо їх розташування є сприятливим для абляції, а функція печінки адекватна.
- Визначення часового проміжку хірургічного втручання після системної терапії здійснюється консиліумом лікарів за участю онколога, радіолога, інших фахівців.
- Пацієнтам, які перенесли резекцію чи абляцію печінки, призначають сорафеніб з метою лікування нерезектабельної ГЦК в ад’ювантній лінії терапії.
- Пацієнтам зі збереженою функцією печінки, якщо рівень білірубіну повернувся до базового та є ознаки залишкової або рецидивної пухлини, для якої неможливе використання додаткових локальних методів лікування, рекомендовано призначити сорафеніб після внутрішньоартеріальних втручань.
- Пацієнтам з неоперабельною пухлиною і непридатним для трансплантації печінки, з локалізованою хворобою, які не є кандидатами на хірургічне втручання через загальний стан здоров’я або супутнє захворювання, пропонують дистанційну (зовнішню) променеву терапію (EBRT) або стереотаксичну променеву терапію (SBRT) як альтернативу абляції та/або емболізації чи коли ці методи лікування виявилися неефективними/протипоказані.
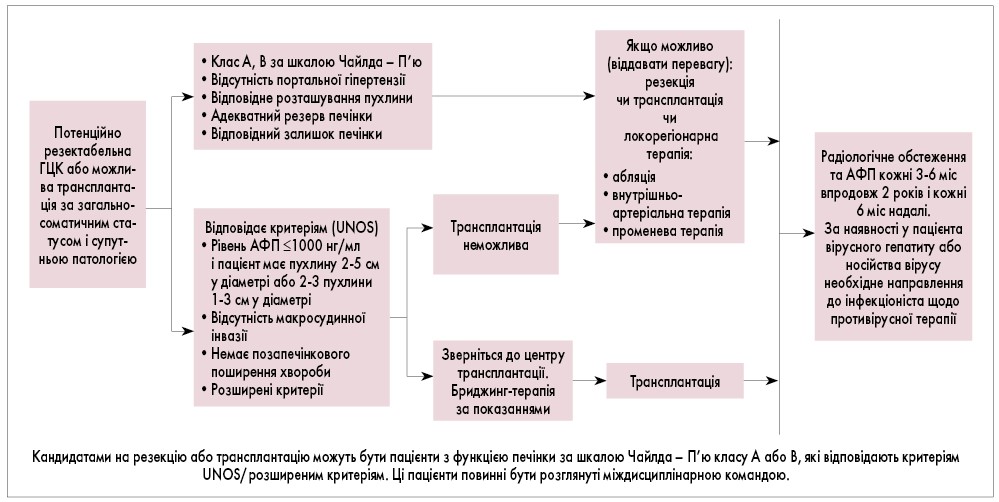 Рис. 4. Алгоритм визначення та оцінки резектабельності ГЦК
Рис. 4. Алгоритм визначення та оцінки резектабельності ГЦК
Панель 2
Принципи системної хіміотерапії ГЦК
Терапія першої лінії
Бажані режими
Атезолізумаб + бевацизумаб (тільки клас А за шкалою Чайлда – П’ю; категорія 1)
Інші рекомендовані режими
Сорафеніб (клас А за шкалою Чайлда – П’ю або B7)
Пембролізумаб (категорія 2B)b [7]
Режими, що використовуються за певних обставин
Атезолізумаб + бевацизумаб (тільки клас B за шкалою Чайлда – П’ю)
Для пухлин із високим мутаційним навантаженням (TMB-H)
Наступні лінії терапії при прогресуванні захворювання
Варіанти
Регорафеніб (тільки клас А за шкалою Чайлда – П’ю)
Кабозантиніб (тільки клас А за шкалою Чайлда – П’ю)]
Сорафеніб (тільки клас А або B7 за шкалою Чайлда – П’ю)
Інші рекомендовані режими
Пембролізумаб (тільки клас А за шкалою Чайлда – П’ю)
Режими, що використовуються за певних обставин
Рамуцирумаб (АФП≥400 нг/мл і тільки клас А за шкалою Чайлда – П’ю)
Для пухлин зі статусом MSI-H/dMMR
Для пухлин з позитивною мутацією у гені RET
Панель 3
Принципи локорегіонарної терапії
Загальні положення
Усі пацієнти з ГЦК повинні пройти обстеження щодо потенційної терапії (резекція, трансплантація, а для невеликих вогнищ – стратегії абляції).
Місцеву, регіонарну терапію слід розглядати у пацієнтів, які не є кандидатами на радикальне хірургічне лікування, або як частину стратегії переведення пацієнтів на іншу терапію. Вони в цілому поділяються на абляцію, артеріально спрямовану терапію та променеву.
Інформація про лікування
Абляція (радіочастотна, кріоабляція, черезшкірна спиртова ін’єкція, мікрохвильова абляція)
Усі пухлини мають піддаватися абляції, якщо проводиться лікування пухлинного утворення та краю здорової тканини у разі термічної абляції. Оцінювання краю не проводиться при черезшкірній ін’єкції етанолу.
Пухлини повинні бути в місці, доступному для абляції черезшкірним/лапароскопічним/відкритим способом.
Слід бути обережними під час абляції вогнищ, що розташовані поблизу великих судин, великих жовчних проток, діафрагми та інших внутрішньочеревних органів.
Сама по собі абляція може бути радикальною при лікуванні утворень ≤3 см. У ретельно відібраних пацієнтів із невеликими правильно розташованими вогнищами необхідно розглянути абляцію як остаточне лікування в контексті мультидисциплінарного підходу. Вогнища розміром від 3 до 5 см можна лікувати з метою продовження життя, використовуючи артеріально спрямовану терапію або комбінацію артеріально спрямованої терапії та абляції, якщо пухлина доступна для абляції.
Нерезектабельні вогнища розміром понад 5 см слід розглянути для лікування за допомогою артеріально спрямованої, системної чи променевої терапії.
Наразі жодна ад’ювантна терапія не була ефективною після абляції.
Артеріально спрямована терапія
Усі пухлини, незалежно від локалізації, можуть бути піддані артеріально спрямованій терапії за умови, що артеріальне кровопостачання пухлини може бути ізольованим без надмірного нецільового лікування.
Артеріально спрямована терапія включає трансартеріальну емболізацію (TAE), хіміоемболізацію (трансартеріальну хіміоемболізацію (TACE) і TACE з кульками, що навантажені ліками (DEB-TACE).
Усі види артеріально спрямованої терапії відносно протипоказані пацієнтам із рівнем білірубіну понад 3 мг/дл, хіба що можливо провести сегментарне лікування.
Системна терапія може бути доцільною після артеріально спрямованої терапії у пацієнтів з адекватною функцією печінки, коли рівень білірубіну повертається до початкового, якщо є докази залишкової/рецидивуючої пухлини, що не піддається додатковому місцевому лікуванню.
Бажані
- З метою зменшення прогресування пухлини і підготовки пацієнта, який є кандидатом на трансплантацію печінки, до операції рекомендовано провести бріджинг-терапію.
- З метою зменшення пухлинної маси (тобто загальної маси злоякісної пухлинної тканини) у відібраних пацієнтів із прогресуючою ГЦК (без віддалених метастазів), які не підпадають під загальноприйняті критерії трансплантації з метою майбутньої пересадки, рекомендовано провести терапію для зниження стадії захворювання (рис. 5).
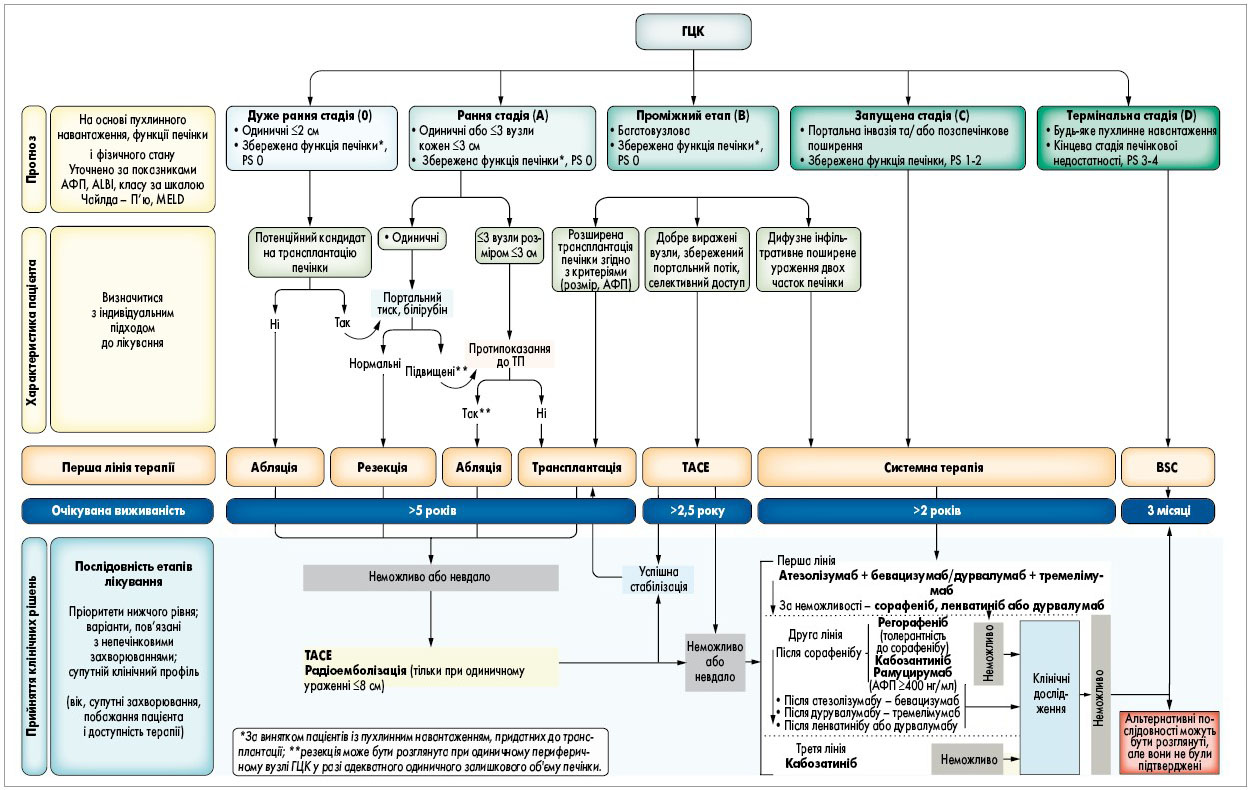 Рис. 5. Стадіювання і загальний алгоритм ведення пацієнтів із ГЦК за системою Барселонської клініки (BCLC, 2022)
Рис. 5. Стадіювання і загальний алгоритм ведення пацієнтів із ГЦК за системою Барселонської клініки (BCLC, 2022)
Розділ ІV. Спостереження пацієнтів із ГЦК
Положення стандарту медичної допомоги. Спостереження пацієнтів із груп ризику щодо можливого розвитку ГЦК і спостереження пацієнтів із ГЦК здійснюється виключно у ЗОЗ, що надають спеціалізовану медичну допомогу.
Спостереження доцільне для пацієнтів із цирозом печінки будь-якої етіології та із хронічним вірусним гепатитом В, навіть за відсутності цирозу.
Спостереження щодо ГЦК потребують пацієнти з груп ризику незалежно від їх віку. АФП і УЗД печінки є найбільш широко використовуваними методами виявлення ГЦК. КТ/МРТ застосовують у випадку неможливості візуалізації або ж нечіткості візуалізації вогнищ ГЦК за допомогою УЗД. Дослідження серологічного рівня АФП може поступово покращити інформативність рентгенологічних методів обстеження.
Пацієнти із хронічним вірусним гепатитом, які отримали противірусну терапію, повною ремісією чи задовільним ефектом повинні проходити спостережні дослідження щодо ГЦК (рис. 6).
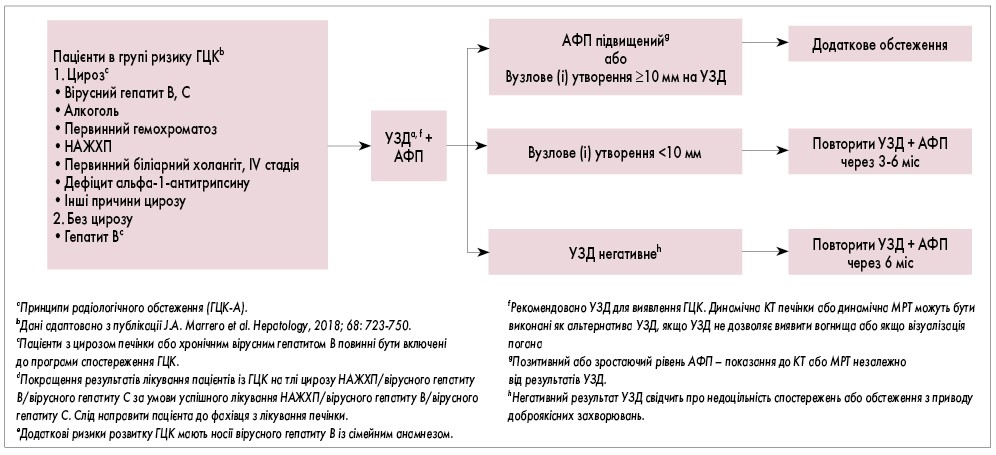 Рис. 6. Алгоритм спостереження пацієнтів із ГЦКа
Рис. 6. Алгоритм спостереження пацієнтів із ГЦКа
Обґрунтування. Існують дані, що спостереження за допомогою визначення рівня сироваткового АФП та УЗД печінки кожні 6 міс може знизити смертність від ГЦК на 37%.
До групи ризику щодо ГЦК входять пацієнти з вірусно-індукованим цирозом печінки (гепатити B і C) і невірусними причинами цирозу (алкогольний цироз, СГ, НАЖХП або НАСГ, первинний біліарний холангіт IV стадії, дефіцит альфа-1-антитрипсину), а також носії вірусу гепатиту В без цирозу, незалежно від причини. Інші менш поширені причини цирозу включають вторинний біліарний цироз, хворобу Вільсона, склерозуючий холангіт, гранульоматозну хворобу, хворобу накопичення глікогену IV типу, медикаментозно-індуковані захворювання печінки, обструкцію венозного відтоку, хронічну правобічну серцеву недостатність і трикуспідальну регургітацію.
Рекомендується проведення обстеження з використанням УЗД і вимірюванням рівня АФП кожні 6 міс у пацієнтів зі встановленими факторами ризику розвитку ГЦК. У разі зростання рівня АФП або виявлення пухлинного вузла печінки розміром ≥10 мм на УЗД рекомендується додаткове обстеження з використанням абдомінальної мультиспіральної КТ або МРТ, засноване на рекомендаціях Американського товариства гепатологів (AASLD) та LI-RADS. Радіологічне визначення характеру пухлин печінки розміром менше 10 мм є складним завданням. Якщо виявлено вузли такого розміру, то УЗД і вимірювання рівня АФП слід повторити через 3-6 міс. Пацієнти з вірусним гепатитом, які мають повну або стійку відповідь на противірусне лікування, повинні продовжувати періодичні обстеження незважаючи на цю відповідь.
Виявлення ранньої ГЦК у пацієнтів із термінальною печінковою недостатністю вважається гіпердіагностикою, останнє може призвести до надмірного лікування, збільшення витрат, несприятливих фізичних наслідків і психологічних збитків без покращення загальної виживаності чи якості життя.
Спостереження. Рекомендується багатофазове високоякісне поперечне зображення грудної клітки, черевної порожнини та таза кожні 3-6 міс протягом 2 років, потім кожні 6 міс. Багатофазова візуалізація поперечного перерізу (тобто КТ або МРТ) є кращим методом для спостереження після лікування через його надійність в оцінці артеріальної васкуляризації, що пов’язано з підвищеним ризиком рецидиву ГЦК після лікування. Підвищені рівні АФП пов’язані з поганим прогнозом після лікування і їх слід вимірювати кожні 3-6 міс протягом 2 років, потім кожні 6 міс. Радіологічну візуалізацію та визначення АФП треба здійснювати щонайменше протягом 5 років. У разі рецидиву захворювання слід розглянути повторну оцінку згідно з початковим дослідженням пацієнтів із неоперабельним ГЦК.
Критерії якості медичної допомоги
Обов’язкові
- Пацієнтам, у яких підтверджено наявність гепатитів С, В у гострій або хронічній формі, з метою виявлення пухлини на ранній стадії необхідно проводити УЗД печінки і дослідження АФП кожні 6 міс.
- Якщо під час мультифазного обстеження з контрастним підсиленням не виявлено пухлинну масу або виявлене утворення однозначно є доброякісним, то пацієнтам рекомендовано повернутися до обстеження (УЗД та АФП через кожні наступні 6 міс).
- Пацієнти з цирозом печінки і тяжкою печінковою дисфункцією (клас С за шкалою Чайлда – П’ю) повинні проходити обстеження, якщо вони є кандидатами на трансплантацію печінки.
- Після завершення програми лікування слід проводити радіологічне обстеження та визначати АФП кожні 3-6 міс впродовж 2 років, а в подальшому кожні 6 міс.
- У разі прогресування/рецидиву захворювання лікування пацієнта здійснюється відповідно до алгоритму (рис. 3).
Індикатори якості медичної допомоги
- Наявність у ЗОЗ, що надає спеціалізовану медичну допомогу, клінічного маршруту пацієнта (КМП) із ГЦК.
- Частка пацієнтів, для яких отримано інформацію щодо медичного стану впродовж звітного періоду.
- Частка випадків ГЦК, виявлених упродовж звітного періоду, для яких діагноз підтверджено.
- Виживаність пацієнтів із ГЦК.
Паспорти індикаторів якості медичної допомоги
1. Наявність у ЗОЗ, що надає спеціалізовану медичну допомогу, КМП із ГЦК. Зв’язок індикатора із затвердженими настановами, стандартами і протоколами медичної допомоги.
Цей індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів у регіоні. Якість медичної допомоги пацієнтам, відповідність надання медичної допомоги вимогам КМП, відповідність КМП чинному СМД цим індикатором висвітлюватися не можуть, але для аналізу цих аспектів необхідне обов’язкове запровадження КМП у ЗОЗ.
Дані надаються закладами спеціалізованої медичної допомоги, розташованими на території обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
2. Частка пацієнтів, для яких отримано інформацію щодо медичного стану впродовж звітного періоду.
Доцільно обраховувати індикатор окремо для лікарів, які надають первинну медичну допомогу, та лікарів-онкологів. При аналізі індикатора слід враховувати неприпустимість формального і необґрунтованого віднесення до чисельника індикатора тих пацієнтів, які не проходили медичний огляд протягом звітного періоду. У первинній медичній документації мають бути задокументовані факти медичного огляду хворого, а також наявність або відсутність повторних проявів захворювання.
Пацієнти, для яких такі записи в медичній документації відсутні, не включаються до чисельника індикатора, навіть якщо лікар має достовірну інформацію про те, що пацієнт живий і перебуває на території обслуговування (за відсутності даних медичного огляду).
Цільовий (бажаний) рівень значення індикатора на етапі запровадження СМД не визначається для запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
Дані надсилаються лікарями, які надають первинну медичну допомогу, розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій. Дані надаються лікарями-онкологами до онкологічного закладу, розташованого на території обслуговування.
Джерелом інформації є форма № 025/о, форма № 030-6/о, база даних Національного канцер-реєстру України.
3. Частка випадків ГЦК, виявлених протягом звітного періоду, для яких діагноз підтверджено морфологічно.
Цільовий (бажаний) рівень значення індикатора на етапі запровадження СМД не визначається для запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
ЗОЗ, який надає дані: онкологічний заклад, канцер-реєстри, інформаційно-аналітичні відділи онкологічних закладів, розташованих на території обслуговування. Національний канцер-реєстр України.
Дані надаються відповідно до вимог технології ведення канцер-реєстру.
4. Виживаність пацієнтів із ГЦК.
Показник відносної виживаності має розраховуватися за допомогою уніфікованого програмного забезпечення Національним канцер-реєстром України, в якому реалізована відповідна методологія. Доцільне обчислення показника 1-, 2-, 3-, 4-, 5-річної відносної виживаності залежно від статі та стадії захворювання.
Неприпустимі прямі порівняння показника відносної виживаності з аналогічними показниками, обчисленими за іншою методологією (1-річна летальність; кількість хворих, які не прожили року з моменту встановлення діагнозу; кількість хворих, що перебувають на онкологічному обліку 5 років і більше, тощо). На валідність показника відносної виживаності впливає повнота даних щодо життєвого стану пацієнтів, які перебувають на онкологічному обліку. У разі значної (більше 5%) кількості випадків, цензурованих через відсутність достовірної інформації про життєвий стан хворих, можлива систематична помилка при порівняннях. Міжрегіональні порівняння показника відносної виживаності мають проводитися з урахуванням статистичної похибки. Слід зважати на загалом недостатню кількість пацієнтів для проведення щорічних міжрегіональних порівнянь.
Дані відносної виживаності пацієнтів із ГЦК, встановлені в 2016-2020 рр., наведені в Бюлетені Національного канцер-реєстру України № 23 «Рак в Україні, 2020-2021. Захворюваність, смертність, показники діяльності онкологічної служби» (інтернет-посилання на сайті Національного канцер-реєстру).
Цільовий (бажаний) рівень значення індикатора на етапі запровадження СМД не визначається для запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
ЗОЗ, який надає дані: онкологічні заклади, канцер-реєстри, інформаційно-аналітичні відділи онкологічних закладів, розташовані на території обслуговування, Національний канцер-реєстр України.
Дата оновлення стандарту – 2028 р.
Текст адаптовано та уніфіковано відповідно до стандартів Тематичного випуску Медичної газети «Здоров’я України».
Повний текст: https://moz.gov.ua
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (71) 2024 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....




