Воздействие дисгликемии на вегетативную функцию организма
 Сахарный диабет (СД) связан с рядом сопутствующих заболеваний. Высокую распространенность при СД как 1, так и 2 типа имеет диабетическая автономная нейропатия (ДАН) с нарушением вегетативного контроля сердечно-сосудистой системы (ССС). В данной публикации рассматривается взаимодействие между дисгликемией и вегетативной дисфункцией, обобщаются методы оценки нарушений вегетативной регуляции ССС и варианты лечения сердечно-сосудистой (кардиальной) автономной нейропатии (КАН).
Сахарный диабет (СД) связан с рядом сопутствующих заболеваний. Высокую распространенность при СД как 1, так и 2 типа имеет диабетическая автономная нейропатия (ДАН) с нарушением вегетативного контроля сердечно-сосудистой системы (ССС). В данной публикации рассматривается взаимодействие между дисгликемией и вегетативной дисфункцией, обобщаются методы оценки нарушений вегетативной регуляции ССС и варианты лечения сердечно-сосудистой (кардиальной) автономной нейропатии (КАН).
ДАН и КАН – одни из наиболее серьезных и распространенных осложнений СД как 1, так и 2 типа, вызывающие значительное увеличение смертности среди пациентов (Trotta D. et al., 2004; Vinik A.I. et al., 2011). Действующие руководства гласят, что оба эти состояния являются частью диабетической нейропатии, которая определяется как «нарушение вегетативной нервной системы, развивающееся при СД или метаболических изменениях на стадии предиабета – после исключения всех иных причин» (Tesfaye S. et al., 2010). Американская диабетическая ассоциация (ADA) различает генерализованную симметричную и асимметричную (фокальную и мультифокальную) нейропатию (Boulton A.J. et al., 2005). ДАН относится к первой группе, при этом различают субклинический (диагностируют только с помощью инструментального обследования) и клинический (сопровождается симптомами или клиническими признаками) варианты симметричной нейропатии.
Субклинический вариант ДАН выявляют при диагностике СД 2 типа и в течение 2 лет после начала СД 1 типа, в то время как сами симптомы и клинические признаки у пациента могут не проявляться долгие годы (Verrotti A. et al., 2014).
Известно, что нарушения периферической вегетативной нервной регуляции могут влиять на любой автономно иннервируемый орган или систему. Соответственно, при ДАН могут наблюдаться различные расстройства: сердечно-сосудистые, желудочно-кишечные, урогенитальные и судомоторные. При этом КАН, как клинически наиболее значимая форма ДАН, определяется как нарушение автономной вегетативной регуляции ССС при СД после исключения всех других причин (Tesfaye S. et al., 2010).
Длительная устойчивая гипергликемия и возникающие метаболические расстройства повреждают вегетативные нервные волокна сердца и сосудов, влияя на регуляцию сердечного ритма, частоту сердечных сокращений (ЧСС), сердечный выброс, сократимость миокарда и тонус сосудов. Такие нарушения вегетативной регуляции могут вызывать опасные осложнения: тяжелую гипогликемию, нарушения сердечного ритма, «немую» ишемию миокарда или внезапную кардиоваскулярную смерть (Tesfaye S. et al., 2010; Yun J.S. et al., 2014).
Для КАН характерно снижение парасимпатического тонуса с относительным повышением симпатической активности, которая обычно диагностируется с помощью вегетативных рефлекторных функциональных тестов.
Эпидемиология
Распространенность ДАН варьируется от 1,6 до 90%. Исследования, изучавшие эпидемиологию КАН, также показывают широкий диапазон: 17-66% у пациентов с СД 1 типа и 31-73% – при СД 2 типа (Fisheret V.L. et al., 2017). Основные причины такого спектра результатов связывают с трудностью диагностики вследствие изменчивости симптомов, с различиями в методике определения распространенности и отсутствием единых диагностических тестов. Дополнительными факторами, влияющими на эпидемиологические показатели, также могут служить продолжительность заболевания, тип СД, недостаточный гликемический контроль, возраст, пол, вес.
Торонтский консенсус по диабетической нейропатии различает 4 стадии КАН: вероятная (ранняя), определенная (подтвержденная), симптоматическая и тяжелая (прогрессирующая). Раннюю КАН можно заподозрить при наличии хотя бы одного аномального кардиоваскулярного рефлекторного теста; для подтвержденной КАН требуется по крайней мере два аномальных вегетативных функциональных теста, основанных на вариабельности сердечного ритма. Наличие ортостатической гипотензии (ОГ) в дополнение к нарушениям сердечного ритма идентифицируют как тяжелую КАН (Spallone V. et al., 2011).
Распространенность вероятной и подтвержденной КАН у пациентов с недавно диагностированным СД 2 типа составляет 15,3 и 1,8% соответственно (Zoppini G. et al., 2015). В двух мультицентровых рандомизированных исследованиях было установлено, что распространенность подтвержденной КАН при обоих типах СД варьируется от 1 до 6,282% (Ziegler D. et al., 1993; Valensi P. et al., 2003). А более длительные исследования показали ежегодный рост случаев КАН: на 2% при СД 1 типа и около 6% при СД 2 типа (Vinik A.I. et al., 2003; Pop-Busui R. et al., 2009). И хотя установлено, что дисбаланс вегетативной регуляции возникает уже на ранней стадии СД, данных о распространенности автономной нейропатии на стадии предиабета крайне мало (Vinik A.I. et al., 2016).
Симптомы и клинические признаки
При ДАН наблюдается широкий спектр клинических проявлений, включая гастропарез, запор, эректильную, судомоторную, нейрососудистую дисфункции или гипогликемическую вегетативную недостаточность. Для КАН характерны снижение толерантности к физическим нагрузкам, тахикардия в состоянии покоя, ортостатическое головокружение, пресинкопальные и синкопальные состояния. Важным клиническим признаком КАН также является сердечная недостаточность; у пациентов с гипогликемией, сердечной недостаточностью и высокой частотой пульса риск смерти существенно повышен (Bellmann B. et al., 2014; DePace N.L. et al., 2014).
Заподозрить КАН можно при наличии тахикардии в состоянии покоя (ЧСС ≥100/мин), ортостатической гипотонии (ОГ) (снижение систолического артериального давления (АД) ≥20 мм рт. ст. в ответ на изменение положения тела) без соответствующей реакции со стороны сердца (учащение ритма). Дополнительными признаками могут служить удлинение интервала QT и нарушение суточного ритма АД. Тахикардия не является специфическим признаком КАН, поскольку также может быть присуща другим вегетативным расстройствам, заболеваниям сердца, ожирению, анемии. Вместе с тем тахикардия имеет определенную прогностическую ценность как в общей, так и в диабетической популяции. В исследовании ADVANCE более выраженная тахикардия покоя у пациентов с СД 2 типа ассоциировалась с повышенным риском смертности от всех причин и кардиоваскулярной смертности (Hillis G.S. et al., 2012).
Более поздним осложнением КАН является ОГ, развивающаяся в результате повреждения эфферентных симпатических вазомоторных волокон, особенно в сосудах внутренних органов (Vinik A.I. et al., 2003). ОГ определяется по снижению АД (≥20 мм рт. ст. для систолического и ≥10 мм рт. ст. для диастолического) в течение 30 мин после вставания пациента из положения лежа.
Клинические тесты для определения вегетативных нарушений
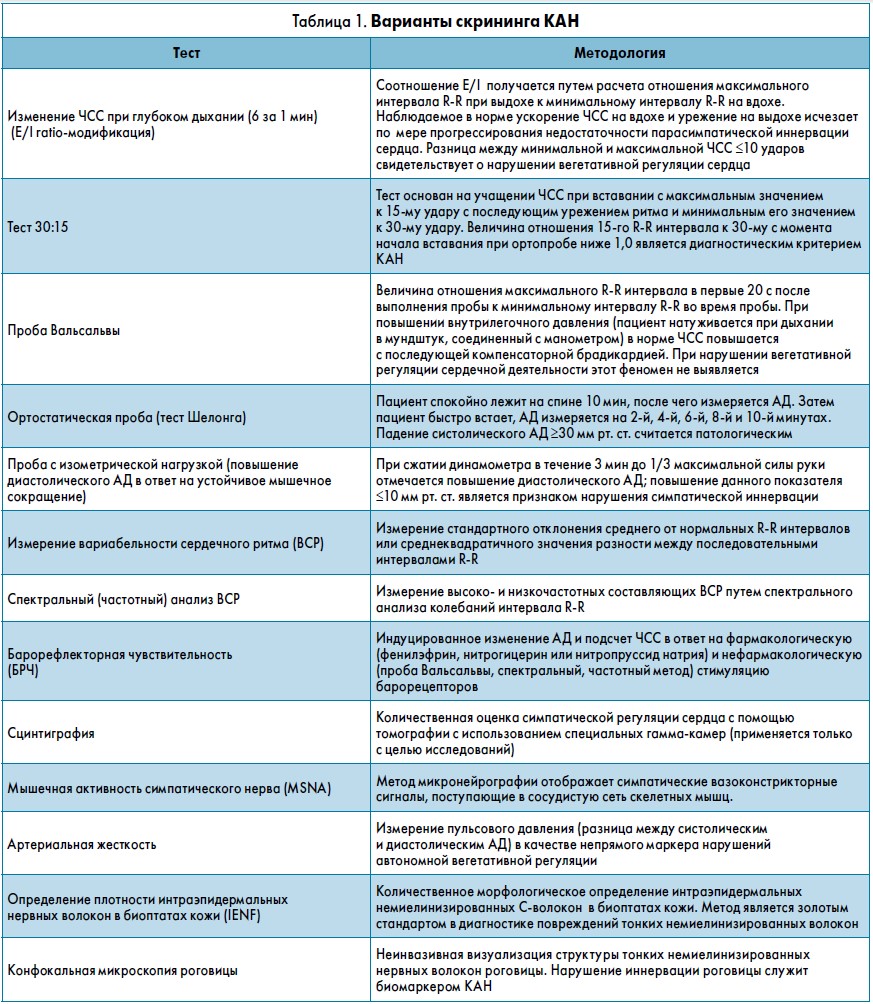 Для диагностики КАН в настоящее время применяются стандартные кардиоваскулярные автономные рефлекторные тесты (КАРТ) и другие методы исследования, отображенные в таблице 1.
Для диагностики КАН в настоящее время применяются стандартные кардиоваскулярные автономные рефлекторные тесты (КАРТ) и другие методы исследования, отображенные в таблице 1.
КАРТ
Согласно рекомендациям Торонтского консенсуса, для подтверждения КАН требуется наличие не менее чем двух положительных тестов. В качестве базовых из классической «батареи» Ewing рекомендованы следующие тесты: соотношение E/I, соотношение 30:15, проба Вальсальвы и тест Шелонга (Ewing D.J. et al., 1980). Оценку ортостатической пробы следует постоянно проводить у пациентов с СД, особенно после 50 лет, даже при отсутствии симптомов (Mansia G. et al., 2007).
Спектральный анализ
Современная технология проведения спектрального анализа позволяет выявлять КАН до появления отклонений в кардиоваскулярных тестах и более точно оценивать вегетативную сердечно-сосудистую функцию (Razanskaite-Virbickiene D. et al., 2017; Bernardi L. et al., 2011). Данный метод основан на использовании математического алгоритма для превращения сигнала ВСР в низкочастотные (НЧ) и высокочастотные (ВЧ) компоненты, соотношение которых оценивается как индекс симпато-парасимпатического баланса.
Барорефлекторная чувствительность
Чувствительность барорефлекса определяется изменением ЧСС в ответ на индуцированную модуляцию АД. Повышение АД вызывает рефлекторную ваготонию и снижение симпатической активности, что приводит к сокращению ЧСС и уменьшению сердечного выброса, а также к повышению периферического сопротивления сосудов; при снижении АД происходят противоположные процессы. У пациентов с СД чувствительность барорефлекса ограничена сердечно-сосудистой ваготонией, тогда как микронейрография позволяет исследовать симпатическую часть барорефлекса (Bernardi L. et al., 2011). БРЧ можно также исследовать с помощью фармакологических методов; золотым стандартом оценки барорефлекса в данном случае считается проба с болюсной инъекцией адреналина.
Другие тесты
Сцинтиграфия является весьма специфическим и дорогостоящим тестом, позволяющим осуществить количественную оценку симпатической кардиоваскулярной регуляции посредством томографии с использованием специальных гамма-камер (Stevenset M.J. et al., 2001). Поэтому данный тест применяется в основном с исследовательской целью, а не в условиях рутиной клинической практики. Для диагностики и мониторинга КАН были предложены некоторые другие тесты: микронейрография, измерение артериальной жесткости и частотно-специфического микроциркуляторного кровотока кожи, определение плотности нервных волокон в интраэпидермальных биоптатах кожи и конфокальная микроскопия роговицы. При этом все диагностические подходы к рутинной оценке КАН нуждаются в дополнительном изучении и стандартизации.
КАН как фактор риска кардиоваскулярной смерти
КАН является маркером риска сердечно-сосудистой заболеваемости и кардиоваскулярнй смертности. Данный факт был доказан в нескольких исследованиях. Так, в 5-летнем проспективном когортном исследовании M. Veglio et al. (2000) было показано, что у пациентов с СД 1 типа и КАН-ассоциированным удлинением интервала QT наблюдалось значительное повышение риска смерти: отношение шансов в среднем составило 24,6 (95% ДИ; 6,5-92,9). В длительном исследовании J. Gerritsen et al. (2001) пациенты с СД и вегетативной дисфункцией имели по крайней мере удвоение риска смерти в течение 9 лет. Метаанализ 15 проспективных исследований, проведенных в период с 1966 по 2000 год (n=2900) с участием больных СД 1 и 2 типов (n=2900) показал достоверное возрастание относительного риска смертности в среднем на 3,65 (95% ДИ; 2,66-4,47) в течение от 1 года до 16 лет при установлении диагноза КАН (Maser R.E. et al., 2003).
Аналогичным образом в своем исследовании S.G. Wheeler и соавт. (2002) предполагают, что снижение ВСР во время глубокого дыхания является независимым фактором риска снижения продолжительности жизни. Дальнейшие исследования обеспечили еще большую поддержку прогностической ценности КАН относительно риска смерти (Ziegler D. et al., 2015).
В своем обзоре I. Oakley et al. (2011) показали, что пациенты с СД и подтвержденной КАН также подвержены более высокому риску интраоперационной сердечно-сосудистой нестабильности и внезапной кардиоваскулярной смерти. КАН изменяет гемодинамический ответ на интубацию трахеи во время общей анестезии, что приводит к интраоперационной гипотензии.
Воздействие дисгликемии на вегетативную (автономную) регуляцию
Гипер-, а также гипогликемия могут быть как фактором риска развития вегетативной дисфункции, так и ее результатом. В отношении гипергликемии было показано, что наличие КАН оказывает неблагоприятное влияние на постпрандиальный гликемический контроль у пациентов с недавно диагностированным СД 2 типа (Dejgaardet T.F. et al., 2014). Что касается гипогликемии, то ночные гипогликемические эпизоды связаны с ухудшением показателей ВСР и удлинением интервала QT по сравнению с периодами нормогликемии; данные признаки наблюдаются у пациентов с СД 1 типа и ранней КАН (Gill G.V. et al., 2009).
Интенсивный гликемический контроль снижает прогрессирование диабетических осложнений, но в то же время приводит к повышенному риску развития гипогликемии. Даже единичный эпизод гипогликемии может привести к срыву вегетативной регуляции в ответ на последующие эпизоды (Matsutani D. et al., 2017; Cha S.A. et al., 2016).
Учащение тяжелых гипогликемических эпизодов коррелирует с увеличением числа положительных тестов при диагностике КАН. Более того, у пациентов с выраженной вегетативной дисфункцией наблюдается более высокая вариабельность уровня гликированного гемоглобина – HbA1c (Ahn Y.B. et al., 2013; Jun J.E. et al., 2015). В свою очередь, вариабельность HbA1c коррелирует с тяжестью КАН.
Таким образом, КАН ассоциируется с нарушением симпато-адренергического ответа на гипогликемию (Lee S.P. et al., 2005) с более высокой частотой эпизодов тяжелой гипогликемии и повышенным кардиоваскулярным риском. Однако и гипогликемия сама по себе может влиять на сердечно-сосудистый вегетативный контроль (Adler G.K. et al., 2009). Вопрос о том, является ли дисгликемия следствием/фактором риска развития КАН или просто маркером тяжести данного осложнения, пока остается открытым.
Профилактика и лечение
Положительное влияние на некоторые показатели сердечно-сосудистой вегетативной функции (улучшение БРЧ и ВСР) оказывают диетогенная потеря веса и бариатрическая хирургия у пациентов с предиабетом, СД 2 типа и ожирением (Casellini C.M. et al., 2016). Аэробные упражнения, прекращение курения в сочетании с фармакологическим контролем АД, нарушений липидного обмена и гипергликемии снижают кардиоваскулярный риск примерно на 50% по сравнению с традиционным лечением СД 2 типа.
Гликемический контроль
Наиболее эффективным методом предотвращения или замедления прогрессирования КАН при СД 1 типа является интенсивный контроль гликемии (Vinik A.I. et al., 2003; Fleischer J. et al., 2012). Стойкие положительные эффекты раннего интенсивного контроля гликемии, по-видимому, связаны с влиянием на феномен «метаболической памяти», которая реализуется посредством ряда механизмов (гликемическая изменчивость, оксидативный стресс, неферментативное гликирование белков, хроническое воспаление и изменения в эпигеноме). Длительное воздействие этих механизмов формирует условия для развития тяжелых диабетических осложнений (Testa R. et al., 2017; Hirsch I.B., 2015; Ceriello A. et al., 2013). При СД 2 типа интенсивный гликемический контроль оказался менее эффективным; исследования ACCORD (2008), ADVANCE (2008), VADT (2009) показали, что риск смертности от всех причин не уменьшается при интенсивном контроле гликемии.
Фармакотерапия
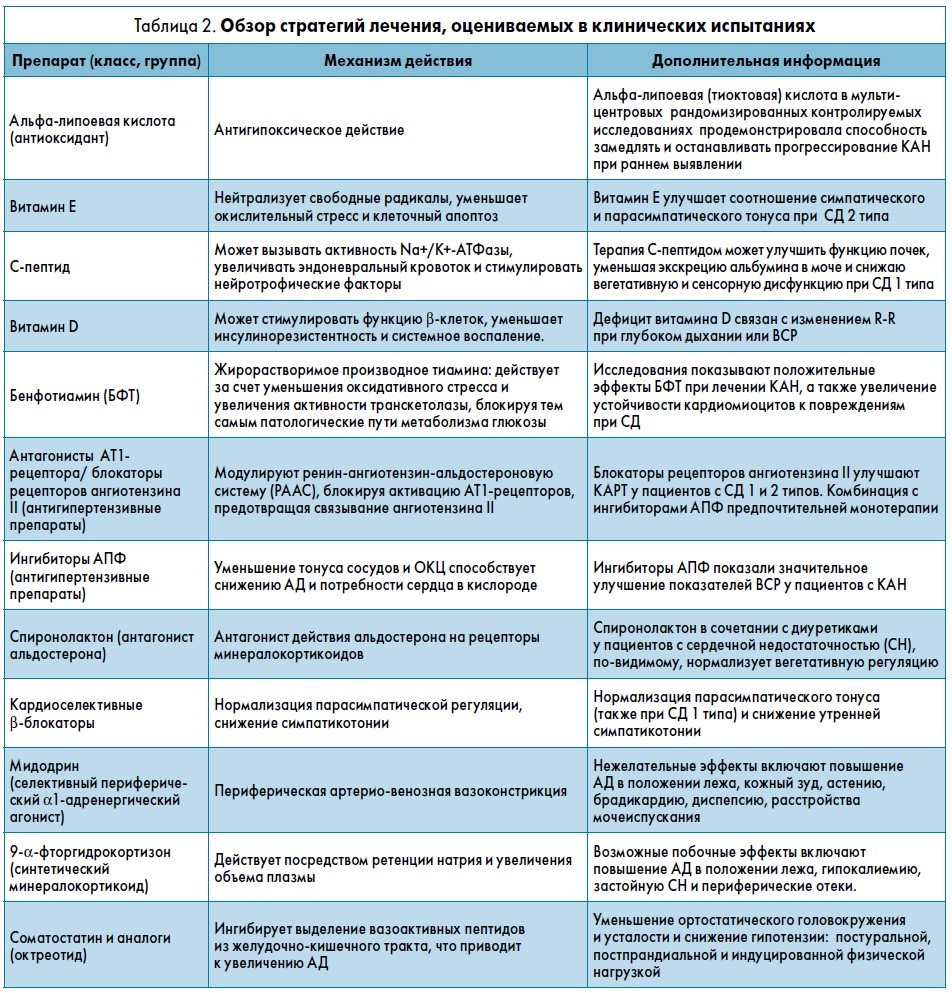 На сегодняшний день имеются лишь ограниченные данные по фармакотерапии КАН, нацеленной на конкретные патогенетические механизмы развития этого осложнения у пациентов с СД (Dimitropoulos G. et al., 2013). На сегодняшний день изучается ряд фармакологических вариантов лечения КАН, однако их использование ограничено отсутствием сравнительных исследований эффективности и клинического опыта применения. Обзор некоторых стратегий лечения КАН представлен в таблице 2.
На сегодняшний день имеются лишь ограниченные данные по фармакотерапии КАН, нацеленной на конкретные патогенетические механизмы развития этого осложнения у пациентов с СД (Dimitropoulos G. et al., 2013). На сегодняшний день изучается ряд фармакологических вариантов лечения КАН, однако их использование ограничено отсутствием сравнительных исследований эффективности и клинического опыта применения. Обзор некоторых стратегий лечения КАН представлен в таблице 2.
Четырехмесячное рандомизированное контролируемое многоцентровое исследование DEKAN (Ziegler D. et al., 1997) показало благоприятное влияние альфа-липоевой кислоты на ВСР у пациентов с СД 2 типа. Витамин Е и C-пептид также продемонстрировали улучшение показателей ВСР при СД 1 типа (Spallone V. et al., 2011).
Предварительные данные указывают на связь между дефицитом витамина D и параметрами КАРТ или ВСР при СД 2 типа (98, 99%), но данных об эффективности профилактики КАН витамином D пока не обнаружено (Jung C.H. et al., 2015; Maser R.E. et al., 2015).
Согласно результатам исследований на животных, использование тиамина при СД 1 типа может предотвратить или, по крайней мере, замедлить прогрессирование КАН, а также улучшить стойкость миокардиоцитов к повреждениям, связанным с метаболическими нарушениями при СД (Koltai M.Z. et al., 1998; Kohda Y. et al., 2008). Кроме того, экспериментальное исследование у пациентов с СД 2 типа показало, что введение бенфотиамина уменьшало хроническое воспаление и стимулировало парасимпатическую активность, что могло бы иметь клиническое значение для предотвращения развития и прогрессирования КАН (Serhiyenko V.A. et al., 2017).
У пациентов с СН (в основном без СД) β-блокаторы (бисопролол) или добавление спиролалактона к эналаприлу, фуросемиду и дигоксину продемонстрировали положительное влияние на вегетативную функцию, проявляющуюся в улучшении парасимпатической регуляции и спектральном анализе ВСР (Pousset F. et al., 1996; Korkmaz M.E. et al., 2000). Более того, у пациентов с СД 2 типа и микроальбуминурией метопролол вызывал значительное улучшение частотных показателей ВСР (Ebbehoj E. et al., 2002).
В других исследованиях применение ингибиторов АПФ показало улучшение вегетативной регуляции у пациентов с СД (Kontopoulos A.G. et al., 1997) и в случаях госпитализации и смертности пациентов с застойной СН (Garg R. et al., 1995). Комбинированное лечение блокаторами рецепторов ангиотензина II и ингибиторами АПФ, судя по всему, превосходит монотерапию (Hamroff G. et al., 1999).
В случае симптоматической ОГ следует уменьшить дозу или отменить препараты, которые могут провоцировать это состояние: сосудорасширяющие средства, диуретики, фенотиазины и трициклические антидепрессанты. Кроме того, необходимо использовать нефармакологические подходы: уменьшить потребление соли, применять соответствующие физические упражнения, избегать перегревания и переедания (особенно пищей, богатой углеводами), ношения тесной одежды (Gibbons C.H. et al., 2017).
Потенциальные риски тех или иных препаратов следует сопоставлять с их возможными преимуществами, в том числе с балансом между достижением целевых уровней АД и предотвращением выраженной гипертензии в положении лежа. К сожалению, несмотря на различные доступные варианты терапии, постуральная гипотензия также остается трудноразрешимой проблемой для многих пациентов.
ДАН и особенно КАН являются серьезными осложнениями у пациентов с СД и характеризуются высокой распространенностью при обоих типах СД. Как следствие, резко возрастает риск кардиоваскулярной заболеваемости и смертности.
Диагностика вегетативной дисфункции основана на ряде автономных рефлекторных тестов, рекомендованных Торонтским консенсусом. Между вегетативной дисфункцией и нестабильным гликемическим контролем существует тесная взаимосвязь; гипер- и особенно гипогликемия являются одновременно факторами риска и результатом нарушения вегетативной функции.
Учитывая патогенетические механизмы развития вегетативной дисфункции, основная роль в профилактике и лечении ДАН/КАН при СД 1 типа отводится гликемическому контролю. В менеджменте СД 2 типа применяется многофакторный подход, в том числе модификация образа жизни пациента наряду с фармакотерапией.
V. Spallone et al., Diabetes Stoffw Herz, 2018.
Подготовила Наталия Позднякова
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (44) грудень 2018 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
Нещодавні дослідження показали, що прогноз за різних поширених захворювань, ендокринних, автоімунних розладів і навіть прогресування раку пов’язані з концентрацією вітаміну D у плазмі. Завдяки експресії гена 1α-гідроксилази (CYP27B1) клітини імунної системи (В-, Т- та антигенпрезентувальні клітини) здатні продукувати активний метаболіт кальциферол – речовину з імуномодулювальними властивостями. Рецептори до вітаміну D (vitamin D receptor, VDR) експресують на поверхні імунних клітин. Доведено зв’язок між поліморфізмом генів VDR або CYP27B1 і патогенезом автоімунних ендокринних захворювань. Метою огляду є вивчення впливу вітаміну D, наслідків його дефіциту та корисної ролі добавок із ним при деяких ендокринних розладах, які часто спостерігають у клінічній практиці. ...
Збудник COVID‑19, SARS-CoV‑2, з яким людство вперше стикнулося у 2019 р., поширився по всьому світу, заразивши мільйони людей. Сьогодні, через тягар війни та економічної нестабільності, тема COVID‑19 не сприймається так гостро, як ще кілька років тому, хоча насправді вона не втратила своєї актуальності. Саме сучасному стану проблеми COVID‑19 у світі та в Україні була присвячена доповідь директора ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», академіка Національної академії медичних наук України, члена-кореспондента НАН України, віце-президента НАМН України, президента Асоціації ендокринологів України, професора Миколи Дмитровича Тронька під час першого у 2024 р. засідання науково-освітнього проєкту «Школа ендокринолога», яке відбулося 20-24 лютого. ...
Протягом останніх 60 років метформін є найпоширенішим цукрознижувальним засобом і рекомендований як препарат першої лінії для осіб з уперше виявленим цукровим діабетом (ЦД) 2 типу. Сьогодні понад 200 млн осіб із ЦД 2 типу в усьому світі щодня застосовують метформін як монотерапію або в комбінації. Препарат усе частіше використовують для лікування гестаційного ЦД та в пацієнтів із синдромом полікістозних яєчників. ...
Двадцять восьмого лютого 2024 року виповнилося 80 років від дня народження директора ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (далі – Інститут), віцепрезидента НАМН України, академіка НАМН України, члена-кореспондента НАН України, заслуженого діяча науки та техніки, лауреата Державної премії України, доктора медичних наук, професора Миколи Дмитровича Тронька....




