Нестероїдні протизапальні препарати в лікуванні нападів мігрені: у фокусі напроксен
Поширеність мігрені серед чоловіків становить приблизно 8%, серед жінок – 12-15%, і це означає, що зазначене захворювання є одним із найрозповсюдженіших на первинній ланці медичної допомоги (Diener H. C. et al., 2008). Цей хронічний розлад характеризується рецидивуючими нападами пульсуючого однобічного головного болю, що часто супроводжується нудотою і блюванням, фото- та фонофобією. Приблизно в кожного п’ятого пацієнта мігренозним болям передує аура у вигляді минущих неврологічних симптомів, найчастіше – миготливих скотом (Pardutz A., Schoenen J., 2010).
Перебіг мігренозної атаки можна поділити на 4 фази: попередня фаза (передує головному болю), аура (безпосередньо передує головному болю або супроводжує його), головний біль і постдромна фаза (після припинення болю) (Charles A., 2013).
Клінічні критерії діагностики мігрені визначені в Міжнародній класифікації головного болю (Headache Classification Subcommittee of the International Headache Society, 2018).
Клінічні критерії діагностики мігрені без аури:
А – щонайменше 5 нападів, котрі відповідають критеріям B-D;
В – тривалість нападів болю становить від 4 до 72 год (без лікування або в разі неефективної терапії);
С – головний біль характеризується щонайменше двома з таких ознак: однобічна локалізація, пульсуючий характер, помірна чи висока інтенсивність, посилення або виникнення під час рутинної фізичної активності;
D – під час нападу спостерігається щонайменше один із таких симптомів: нудота та/або блювання, фото- чи фонофобія;
Е – біль не спричинений іншим захворюванням.
Клінічні критерії діагностики мігрені з аурою:
А – щонайменше 2 напади, котрі відповідають критеріям B і С;
В – щонайменше один повністю зворотний симптом аури: зоровий, сенсорний, моторний, мовний, стовбуровий чи з боку сітківки;
С – щонайменше 3 із 6 таких характеристик: ≥1 симптом аури розвивається поступово протягом ≥5 хв та/або ≥2 симптоми розвиваються послідовно; кожен окремий симптом аури триває 5-60 хв; щонайменше один симптом аури є однобічним та/або позитивним; аура супроводжується або змінюється головним болем упродовж 60 хв;
D – біль не спричинений іншим захворюванням.
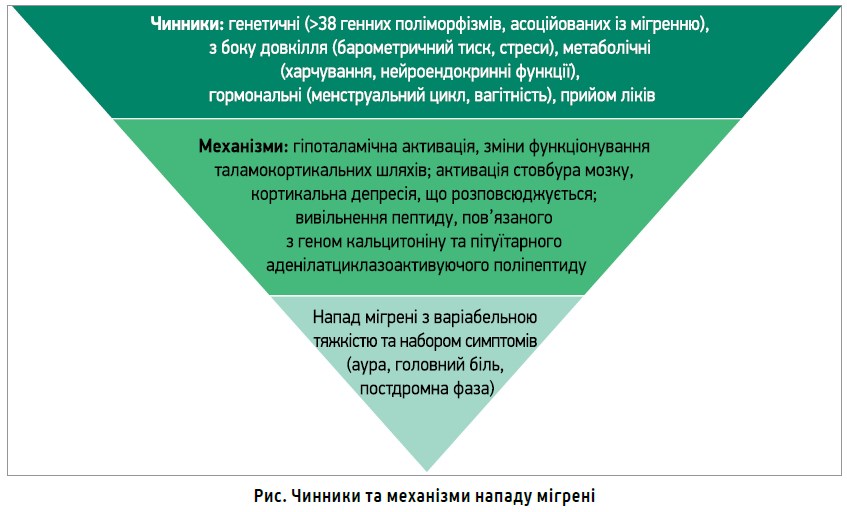
Причинами нападу мігрені слугують різноманітні чинники та механізми (рис.): його можуть провокувати навіть медикаменти, в т. ч. антимігренозні засоби, пероральні контрацептиви, гормонозамісні препарати, що застосовуються під час менопаузи, деконгестанти, селективні інгібітори зворотного захоплення серотоніну, інгібітори протонної помпи (Charles A., 2017).
Лікування мігрені розпочинається із немедикаментозних методів, зокрема з нормалізації харчування та режиму сну, регулярних фізичних навантажень. Окрім того, може застосовуватися превентивна фармакотерапія (β-блокатори, трициклічні антидепресанти, антиконвульсанти тощо). Для усунення нападів використовується інша група медикаментів (Charles A., 2017).
Хоча протягом останніх двох десятиліть як протимігренозні препарати найактивніше промотувалися триптани, найзастосовуванішим класом медикаментів у лікуванні головного болю в цілому та мігрені зокрема дотепер залишаються нестероїдні протизапальні препарати (НПЗП) (Lipton R. B. et al., 2001; 2003). Перевагами НПЗП є більша доступність, хороша ефективність (деякі з них, як-от напроксен, практично не поступаються за ефективністю триптанам), відносно низький потенціал абузусного головного болю, сприятливе співвідношення ефективність/безпека, менша вартість (Pardutz A., Schoenen J., 2010; American Migraine Foundation, 2011).
Консенсус Американського товариства головного болю (2019) рекомендує застосовувати НПЗП, неопіоїдні аналгетики, ацетамінофен або кофеїновмісні комбінації аналгетичних препаратів у разі мігренозних болів незначної/помірної інтенсивності та мігреноспецифічні препарати (триптани, дигідроерготамін) – у разі нападів помірної/високої інтенсивності болю чи мігренозних атак, що погано відповідають на лікування НПЗП або кофеїновмісними комбінаціями (American Headache Society, 2019; Brauser D., 2019).
Основа дії усіх НПЗП – блокада ферменту циклооксигенази з відповідним зменшенням синтезу простагландинів з арахідонової кислоти. Водночас синтез лейкотрієнів залишається незмінним (Pardutz A., Schoenen J., 2010). Слід зауважити, що застосування НПЗП зумовлене не лише їх знеболювальною дією, а й непрямими доказами участі простагландинів у патофізіології мігрені (Tulunay F. C., 2000).
Незважаючи на широкий спектр наявних НПЗП, не всі з них добре вивчені й однаково ефективні при мігрені. Напроксен неодноразово оцінювали в клінічних дослідженнях за участю хворих із мігренню, в т. ч. порівнювали з триптанами. У дослідженні K. Nestvold і співавт. (1985) напроксен за ефективністю перевищував плацебо щодо усунення гострих нападів мігрені та усіх її проявів (головного болю, нудоти/блювання, фотофобії, запаморочення). Натрієва сіль напроксену (медикамент із покращеними фармакокінетичними властивостями) також ефективніше за плацебо, адже дієвіше усуває біль та зменшує потребу в додатковій аналгезії (Johnson E. S. et al., 1985). Напроксен може застосовуватися не лише як монотерапія, а й у складі мультимодальної аналгезії. Так, комбінація напроксену із суматриптаном за ефективністю перевищувала як плацебо, так і будь-який один із компонентів (Brandes J. L. et al., 2007; Landy S. et al., 2007; Smith T. R. et al., 2005). В одному з цих досліджень монотерапія напроксеном не поступалася монотерапії суматриптаном у ліквідації болю через 2 год після прийому препарату (Brandes J. L. et al., 2007). Була також продемонстрована перевага напроксену натрію над комбінацією ерготаміну, кофеїну та циклізину (Pradalier A. et al., 1985). У дослідженні B. W. Friedman і співавт. (2010) напроксен (500 мг) і суматриптан (100 мг) однаково ефективно знижували інтенсивність первинних головних болів та мігрені після виписки з відділення невідкладної терапії.
Напроксен може застосовуватися для так званої мініпрофілактики менструальної мігрені. У такому разі препарат слід починати приймати за 1-2 дні до очікуваного нападу; рекомендована тривалість прийому становить 4-12 днів (Diamond S. et al., 2015).
Продемонстровано, що напроксен послаблює активацію ноцицепторів твердої мозкової оболонки та зменшує периферичну ноцицептивну сенситизацію (Levy D. et al., 2008). Такі властивості є доповненням інгібування циклооксигенази, сприяючи ефективності цього препарату при мігрені.
Ключовим фармакокінетичним аспектом у лікуванні нападів мігрені є швидкість усмоктування препарату. НПЗП швидко абсорбуються після перорального вживання; для більшості препаратів час до досягнення пікової концентрації в плазмі крові становить <2 год (Hardman J. G. et al., 1996). Для покращення всмоктування НПЗП і швидшого настання ефекту створено форми з покращеною розчинністю (наприклад, натрієва сіль напроксену) (Pardutz A., Schoenen J., 2010).
Під час вибору НПЗП слід зважати на гастроінтестинальну та кардіоваскулярну безпеку обраних препаратів. У великому дослідженні A. Lanas і співавт. (2006) відносний ризик кровотеч із верхніх відділів шлунково-кишкового тракту для всіх НПЗП у середньому становив 5,3, тоді як для напроксену цей показник був нижчим і дорівнював 4. Кардіоваскулярний ризик для напроксену виявився нижчим, ніж для рофекоксибу (Bombardier C. et al., 2000).
Отже, обираючи НПЗП, слід звернути увагу на препарати зі швидким усмоктуванням й оптимальним балансом ефективності та безпеки. Одним з таких медикаментів є напроксен. На фармацевтичному ринку України зареєстровано препарат напроксену натрію Напрофф (Rotapharm Limited, Велика Британія), серед показань до застосування якого є больові синдроми різної етіології, в тому числі мігренозні болі.
Підготувала Лариса Стрільчук
| Медична газета «Здоров’я України 21 сторіччя» № 7 (476), квітень 2020 р. |
СТАТТІ ЗА ТЕМОЮ Неврологія
Стрес і тривожність чинять потужний несприятливий вплив і на самопочуття окремих індивідуумів, і на загальний стан здоров’я всієї популяції світу. Цей несприятливий вплив значно підсилили пандемія COVID‑19 та війна в Україні (Celuch M. et al., 2023)....
16-17 лютого в Києві відбувся науково-практичний майстер-клас «Хронічний стрес сьогодення: обрані запитання про здоров’я жінки в різні вікові періоди». Під час заходу виступили фахівці різних спеціальностей, було обговорено важливі аспекти жіночого здоров’я як психологічного, так і фізичного. Доповіді присвячувалися різноманітним питанням, зокрема репродуктивним проблемам, онкологічним захворюванням, психосоматичним розладам. Під час події виступила засновниця Академії довголіття Dr. Skytalinska, віцепрезидент Асоціації дієтологів України, лікар-дієтолог Оксана Василівна Скиталінська. Доповідь Оксани Василівни була присвячена впливу тривалого стресу на харчування та пов’язані з цим наслідки для здоров’я жінок. Окрім пояснення механізмів негативного впливу стресу, під час доповіді лікарка також надала важливі практичні рекомендації стосовно здорового харчування....
Події останніх 5 років є неабияким викликом для психічного стану кожного українця: спочатку – пандемія коронавірусу та запроваджені через неї карантинні обмеження, а далі – повномасштабне російське вторгнення, що триває уже понад 2 роки. Все це спричиняє погіршення психічного здоров’я населення. Такі надзвичайні ситуації, що характеризуються загрозою з невизначеною тривалістю, створюють масивне стресове навантаження, яке підсилюється відчуттям самотності та відчуженості, підвищують тривожність, а також є підґрунтям розвитку психічних розладів. Відомо, що ці стани порушують розумову діяльність, тобто перешкоджають концентрації та аналізу інформації. ...
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....