Раміприл: потужна антигіпертензивна дія та доведене покращення прогнозу
У наш час, коли переваги нормалізації артеріального тиску (АТ) чітко доведено, а на фармацевтичному ринку наявна велика кількість антигіпертензивних препаратів (АГП), перед лікарем постає проблема вибору оптимального засобу. Серед схвалених провідними фаховими товариствами п’яти класів АГП особливу увагу привертають інгібітори ангіотензинперетворювального ферменту (ІАПФ) як медикаменти, котрим притаманна низка додаткових сприятливих кардіоваскулярних впливів.
Доведено, що поряд зі зниженням АТ препарати класу ІАПФ мають й інші корисні в терапевтичному сенсі властивості, а саме метаболічні (покращення обміну глюкози, нейтральність щодо обміну ліпідів), кардіопротекторні (зниження перед- і постнавантаження, зменшення маси міокарда лівого шлуночка та покращення його ремоделювання, зниження симпатичної стимуляції, мінімізація реперфузійного пошкодження) й вазопротекторні (пряма антиатерогенна дія, посилений ендогенний фібриноліз, запобігання агрегації тромбоцитів, антипроліферативна й антиміграторна дія на лейоміоцити, зменшення утворення колагенового матриксу, покращення ендотеліальної функції, протизапальний та антиоксидантний ефекти, поліпшення тонусу артерій, запобігання розриву атеросклеротичних бляшок) (Lonn E. et al., 2003).
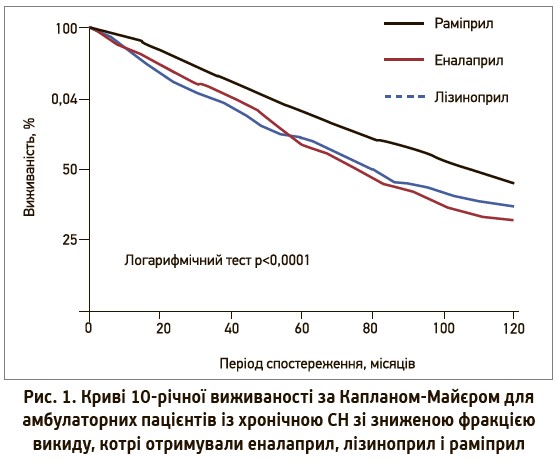 ІАПФ не лише ефективно знижують рівень АТ, а й зменшують захворюваність і смертність у пацієнтів із серцевою недостатністю (СН) і післяінфарктних хворих. Утім, переваги щодо покращення прогнозу не є однаковими для представників цієї групи лікарських засобів.
ІАПФ не лише ефективно знижують рівень АТ, а й зменшують захворюваність і смертність у пацієнтів із серцевою недостатністю (СН) і післяінфарктних хворих. Утім, переваги щодо покращення прогнозу не є однаковими для представників цієї групи лікарських засобів.
Найбільший інтерес становлять препарати з підвищеною спорідненістю до тканинного АПФ, які теоретично можуть мати переваги щодо захисту органів-мішеней: серця, нирок, судин, головного мозку (так званої органопротекції). Одним із таких препаратів є раміприл. Так, у метааналізі W.P. Sun і співавт. (2016), який включав 29 досліджень, з’ясувалося, що застосування лізиноприлу порівняно з плацебо та раміприлом асоціювалося з вищою частотою смерті від усіх причин. Моноваріантний порівняльний аналіз застосування різних ІАПФ у пацієнтів із хронічною СН, проведений H. Frohlich і співавт. (2017), виявив, що в пацієнтів, яким було призначено еналаприл і лізиноприл, спостерігалися вищі показники смертності порівняно з відповідним показником в учасників, які приймали раміприл (рис. 1).
Наріжним каменем доказової бази раміприлу є дослідження HOPE. Результати HOPE мали величезний вплив на клінічні рекомендації та практику в усьому світі.
Дослідження НОРЕ було проведено в 19 країнах і тривало 5 років. Характеристика пацієнтів, які були включенні в дослідження: вік учасників був ≥55 років, вони страждали від серцево-судинних захворювань (ішемічна хвороба серця, інсульт, захворювання периферичних артерій) або мали цукровий діабет (ЦД), але не мали СН. Протягом 4,5 років хворі отримували раміприл у дозі 10 мг/добу чи плацебо.
 За результатами цього випробування, раміприл зменшував частоту кардіоваскулярної смерті (ВР 0,74; p<0,001), інфаркту міокарда (ВР 0,80; p<0,001), смерті від усіх причин (ВР 0,84; p=0,005) і пов’язаних із діабетом ускладнень (6,4 проти 7,6%; ВР 0,84; p=0,03) порівняно з плацебо (Yusuf S. et al., 2000) (рис. 2).
За результатами цього випробування, раміприл зменшував частоту кардіоваскулярної смерті (ВР 0,74; p<0,001), інфаркту міокарда (ВР 0,80; p<0,001), смерті від усіх причин (ВР 0,84; p=0,005) і пов’язаних із діабетом ускладнень (6,4 проти 7,6%; ВР 0,84; p=0,03) порівняно з плацебо (Yusuf S. et al., 2000) (рис. 2).
Дослідження HOPE також мало на меті з’ясувати вплив раміприлу на частоту інсультів і транзиторних ішемічних атак. Зменшення частоти інсультів у групі раміприлу зафіксовано вже протягом першого року лікування, надалі ця тенденція зберігалася. На додачу в групі раміприлу рідше спостерігалися множинні інсульти, ніж у групі плацебо, а функціональні розлади після інсульту були менш вираженими. Зниження ймовірності інсульту відзначалося в різних підгрупах дослідження, в тому числі в учасників з анамнезом цереброваскулярних і коронарних захворювань, хвороб периферичних артерій або ЦД, а також не залежало від супутнього лікування (антитромбоцитарні та ліпідознижувальні засоби). На думку авторів дослідження, пацієнтам із високим ризиком розвитку інсульту варто призначати раміприл незалежно від вихідного рівня АТ (Bosch J. et al., 2002).
У зв’язку з чіткими перевагами раміприлу дослідження було припинено достроково. Цікаво, що після стандартизації за змінами систолічного (САТ) і діастолічного АТ (ДАТ) раміприл продовжував демонструвати кардіоваскулярні переваги. Це свідчить про те, що зазначений препарат не лише чинить антигіпертензивну дію, а й має вазо- та нефропротекторний ефекти (HOPE investigators, 2000).
Значною проблемою в лікуванні кардіологічних хворих є наявність супутніх метаболічних розладів, передусім ЦД. Однак сучасні препарати дають змогу зменшити ймовірність розвитку цього захворювання. У дослідженні ADaPT (n=2011) пацієнтів було розподілено на групи лікування артеріальної гіпертензії (АГ) на основі раміприлу (монотерапія чи поєднання з блокаторами кальцієвих каналів – БКК) і діуретиків (без застосування інгібіторів ренін-ангіотензин-альдостеронової системи – РААС). Через 3 роки спостереження в групі раміприлу мали місце достовірно менша частота розвитку ЦД (24,4 проти 29,5%; p<0,05) і достовірне зменшення кардіоваскулярної смертності порівняно з відповідними показниками в групі діуретиків (p=0,033). Схожі результати було отримано в низці інших досліджень (AASK, HOPE, DREAM). У хворих, які отримували діуретики, відзначалася більша частота побічних ефектів, у тому числі тяжких (15,4 проти 12,4%; p<0,05). Автори зробили висновок, що варто віддавати перевагу раміприлу над діуретиками, оскільки це дає змогу відтермінувати розвиток ЦД (Zidek W. et al., 2012).
Слід також зазначити, що раміприл продемонстрував виражену нефропротекцію за рівнем альбумінурії. Хоча на початку дослідження рівень альбумінурії був у 1,5 раза вищим у групі раміприлу (33,8±131,4 проти 19,4±38,2 мг/дл; p<0,01), через 4 роки спостереження альбумінурія в групі раміприлу на 30% знизилася (до 23,6±67,0 мг/дл), натомість у групі діуретиків на 128% зросла (до 44,3±255,4 мг/дл) (Zidek W. et al., 2012).
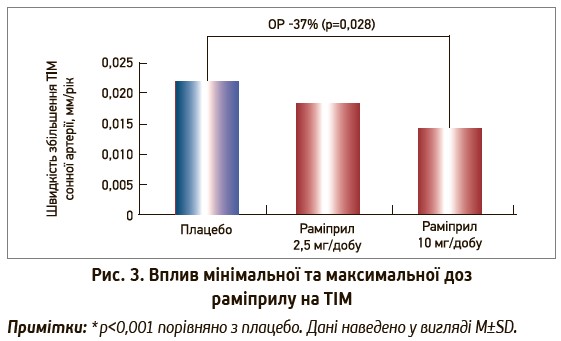 З огляду на особливості раміприлу через його високу афінність до тканинної РААС звертає на себе увагу антиатеросклеротична дія раміприлу як одне з пояснень його профілактичного ефекту. У рамках НОРЕ було проведено проспективне подвійне сліпе дослідження SECURE, в якому порівнювали вплив раміприлу та плацебо на товщину інтима-медії (ТІМ) сонних артерій за допомогою ультразвукового дослідження. У випробування було включено 732 пацієнти, котрі отримували раміприл у мінімальній (2,5 мг/добу) та максимальній (10 мг/добу) дозі чи плацебо. Середня тривалість спостереження – 4,5 роки. Швидкість збільшення максимальної ТІМ сонних артерій становила 0,0217 мм/рік у групі плацебо, 0,0180 мм/рік – у групі раміприлу при мінімальній дозі прийому 2,5 мг і 0,0137 мм/рік – у групі раміприлу за умови прийому в дозі 10 мг/добу (р=0,033). Отже, тривала терапія раміприлом у терапевтичній добовій дозі 10 мг сприяла уповільненню швидкості прогресування атеросклерозу (рис. 3).
З огляду на особливості раміприлу через його високу афінність до тканинної РААС звертає на себе увагу антиатеросклеротична дія раміприлу як одне з пояснень його профілактичного ефекту. У рамках НОРЕ було проведено проспективне подвійне сліпе дослідження SECURE, в якому порівнювали вплив раміприлу та плацебо на товщину інтима-медії (ТІМ) сонних артерій за допомогою ультразвукового дослідження. У випробування було включено 732 пацієнти, котрі отримували раміприл у мінімальній (2,5 мг/добу) та максимальній (10 мг/добу) дозі чи плацебо. Середня тривалість спостереження – 4,5 роки. Швидкість збільшення максимальної ТІМ сонних артерій становила 0,0217 мм/рік у групі плацебо, 0,0180 мм/рік – у групі раміприлу при мінімальній дозі прийому 2,5 мг і 0,0137 мм/рік – у групі раміприлу за умови прийому в дозі 10 мг/добу (р=0,033). Отже, тривала терапія раміприлом у терапевтичній добовій дозі 10 мг сприяла уповільненню швидкості прогресування атеросклерозу (рис. 3).
Рекомендації з лікування АГ Європейського товариства гіпертензії та Європейського товариства кардіологів (2018) указують, що терапією першого вибору в більшості гіпертензивних хворих є фіксована комбінація блокатора РААС і БКК або діуретика. Проте докази метааналізів контрольованих досліджень свідчать, що не слід урівнювати різні класи блокаторів РААС, оскільки ІАПФ мають перевагу над блокаторами рецепторів ангіотензину ІІ (БРА) в запобіганні інфаркту міокарда та зниженні загальної смертності (Taddei S., 2019).
Дослідження ASCOT й ACCOMPLISH однозначно продемонстрували перевагу комбінації ІАПФ/БКК над сполученням β-блокатор/діуретик, натомість для комбінацій БРА/БКК такі докази відсутні.
Комбінація ІАПФ і БКК протягом багатьох років успішно застосовується в антигіпертензивній терапії. БКК проявляють легкий діуретичний ефект, підвищуючи активність симпатичної нервової системи та РААС. ІАПФ зменшують ці ефекти, а також запобігають набряку гомілки – побічному явищу дигідропіридинових БКК. Обидва класи препаратів є метаболічно нейтральними й не зумовлюють побічних реакцій із боку центральної нервової системи.
Раміприл та амлодипін виступають своєрідними референсними молекулами у своїх класах, оскільки їхню антигіпертензивну ефективність, сприятливий вплив на прогноз і хорошу переносимість було доведено в низці досліджень. Отже, сполучення цих молекул в одному препараті, поза сумнівом, є вдалим вибором для лікування АГ (Taddei S., 2019).
В угорському проспективному дослідженні IV фази RAMONA оцінювали ефективність і безпеку фіксованої комбінації раміприлу й амлодипіну виробництва компанії «Егіс» у різних дозах у раніше лікованих пацієнтів із легкою чи середньої тяжкості АГ (n=6423), які не досягли цільового рівня АТ на тлі попередньої антигіпертензивної терапії. На тлі лікування фіксованою комбінацією раміприлу й амлодипіну вже через 4 тиж було відзначене достовірне (p<0,0001) зниження АТ (САТ – зі 158,04 до 138,77 мм рт. ст. і ДАТ – із 90,46 до 82,12 мм рт. ст.). За період подальшого спостереження АТ продовжував зменшуватися, і наприкінці дослідження (4 міс терапії) середні САТ і ДАТ становили 130,40 та 78,59 мм рт. ст. відповідно. Загалом за час спостереження САТ знизився в середньому на 28 мм рт. ст., ДАТ – на 12 мм рт. ст. Лікування хворих супроводжувалося низкою позитивних ефектів на метаболічні параметри. Стосовно ліпідного обміну відзначене достовірне (p<0,0001) зниження рівня загального холестерину з 5,30 до 5,10 ммоль/л і достовірне (p<0,01) підвищення рівня ліпопротеїнів високої щільності з 1,32 до 1,46 ммоль/л, щодо ліпопротеїнів низької щільності виявлено подібну тенденцію (початково – 3,13 ммоль/л, через 4 міс – 2,98 ммоль/л). Також привернуло увагу достовірне (p<0,0001) зниження рівня сечової кислоти (з 360,20 до 349,70 мкмоль/л на початку та наприкінці лікування відповідно).
Результати дослідження свідчать, що фіксована комбінація раміприлу/амлодипіну може мати значні довгострокові переваги стосовно майбутніх кардіоваскулярних подій. Слід наголосити, що зафіксований показник досягнення цільового АТ можна ще покращити шляхом призначення максимальних доз раміприлу й амлодипіну в складі фіксованої комбінації (10/10 мг), оскільки цю дозу на візиті отримували лише 37,5% пацієнтів.
Ще однією ефективною та добре вивченою фіксованою комбінацією є поєднання раміприлу та гідрохлортіазиду (ГХТЗ). У дослідженні Р.А. Modesti та співавт. (2001) через 4 тиж лікування раміприлом/ГХТЗ середньодобовий систолічний АТ знизився зі 144±9 до 123±5 мм рт. ст., а середньодобовий діастолічний АТ – із 90±7 до 78±6 мм рт. ст. Слід зауважити, що за співвідношенням пік/корито комбінація раміприл/ГХТЗ забезпечувала стабільніший антигіпертензивний ефект і менші добові коливання АТ, ніж поєднання каптоприлу з ГХТЗ.
На фармацевтичному ринку України раміприл, серед іншого, представлений лінійкою препаратів угорської компанії «Егіс», а саме: Хартил® (раміприл у дозах 5 і 10 мг); Хартил® АМ (раміприл/амлодипін у дозах 5/5, 5/10, 10/5 і 10/10 мг) і Хартил®-Н (раміприл/ГХТЗ у дозах 2,5/12,5 та 5/25 мг). Спектр показань для застосування раміприлу включає лікування АГ, захворювань нирок (клубочкова нефропатія діабетичного та недіабетичного генезу), СН, а також профілактику серцево-судинних захворювань, у тому числі вторинну профілактику після перенесеного гострого інфаркту міокарда. Наявність широкого спектра комбінацій і доз препаратів лінійки Хартил® дає можливість обрати оптимальне лікування для кожного пацієнта з АГ – від осіб низького ризику з незначним підвищенням АТ до хворих із високим ступенем АГ, супутніми метаболічними розладами та високим кардіоваскулярним ризиком.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 15 (484), 2020 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




