Глюкокортикоїди при ревматичних захворюваннях: еволюція поглядів
 Глюкокортикоїди (ГК) широко застосовуються майже при всіх запальних ревматичних захворюваннях. Діапазон терапевтичного ефекту ГК простирається від знеболювального на пізніх стадіях ревматоїдного артриту (РА) та хворобо-модифікуючого – на ранніх (у межах 6-місячного терапевтичного вікна) до значного імуносупресивного при васкулітах, системному червоному вовчаку (СЧВ) та інших захворюваннях сполучної тканини. Незважаючи на розвиток нових лікувальних можливостей, зокрема біологічної терапії, ГК вже протягом 70 років посідають перше місце за частотою призначення у лінійці протиревматичних препаратів. Дані Walsh та Ramsey-Goldman свідчать, що від 0,5 до 1% загальної популяції тривало приймають ГК. Доведено їхню високу ефективність майже при всіх запальних та автоімунних ревматичних захворюваннях завдяки впливу на всі ланки патогенезу. Довгострокове застосування ГК обмежене лише розвитком значної кількості побічних реакцій (ПР), які напряму залежать від дози, тривалості використання та ступеня впливу різних ГК на гіпоталамо-гіпофізарно-наднирникову систему (ГГНС). Вибір дози залежить від поточного ревматологічного захворювання, його активності, індивідуальної відповіді на лікування, а також наявності супутніх патологій і факторів ризику ПР (van der Goes, 2014).
Глюкокортикоїди (ГК) широко застосовуються майже при всіх запальних ревматичних захворюваннях. Діапазон терапевтичного ефекту ГК простирається від знеболювального на пізніх стадіях ревматоїдного артриту (РА) та хворобо-модифікуючого – на ранніх (у межах 6-місячного терапевтичного вікна) до значного імуносупресивного при васкулітах, системному червоному вовчаку (СЧВ) та інших захворюваннях сполучної тканини. Незважаючи на розвиток нових лікувальних можливостей, зокрема біологічної терапії, ГК вже протягом 70 років посідають перше місце за частотою призначення у лінійці протиревматичних препаратів. Дані Walsh та Ramsey-Goldman свідчать, що від 0,5 до 1% загальної популяції тривало приймають ГК. Доведено їхню високу ефективність майже при всіх запальних та автоімунних ревматичних захворюваннях завдяки впливу на всі ланки патогенезу. Довгострокове застосування ГК обмежене лише розвитком значної кількості побічних реакцій (ПР), які напряму залежать від дози, тривалості використання та ступеня впливу різних ГК на гіпоталамо-гіпофізарно-наднирникову систему (ГГНС). Вибір дози залежить від поточного ревматологічного захворювання, його активності, індивідуальної відповіді на лікування, а також наявності супутніх патологій і факторів ризику ПР (van der Goes, 2014).
Механізм дії
Ефекти ГК реалізуються через різні механізми: геномні та негеномні ефекти.
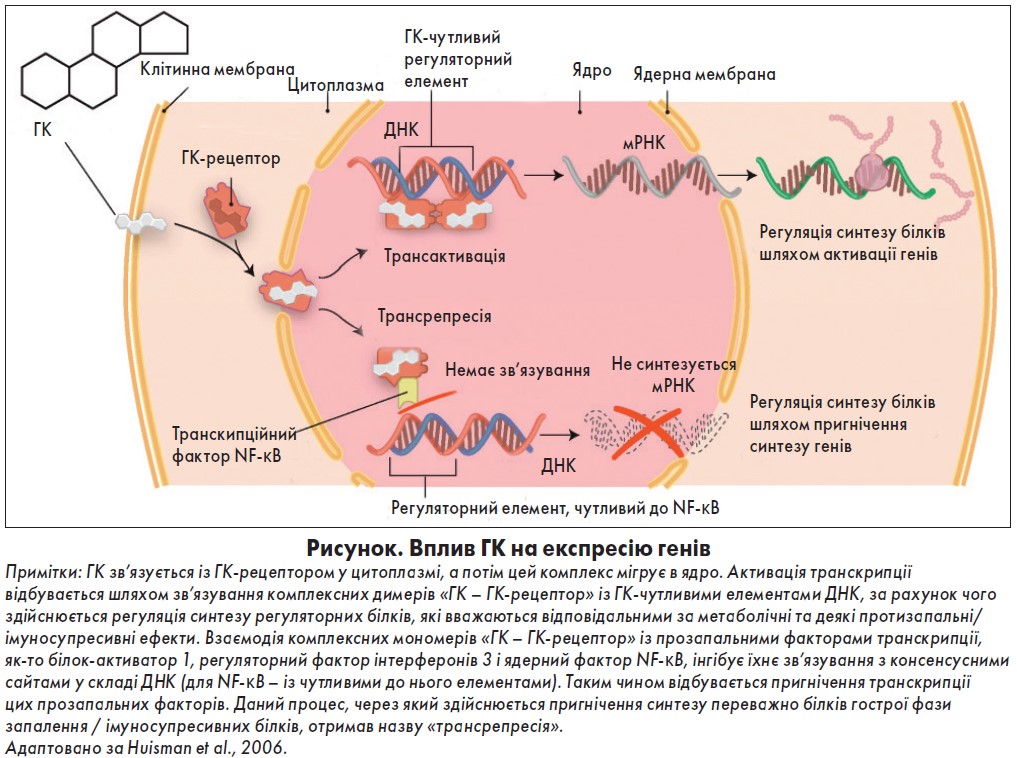
Класичні геномні ефекти, які призводять до зміни експресії генів на етапі транскрипції, найбільш важливі при використанні низьких доз. ГК легко проникають через клітинну мембрану, зв’язуються зі специфічними цитозольними ГК-рецепторами, і після активації комплекс «ГК – ГК-рецептор» транспортується до ядра. В ядрі відбуваються процеси трансактивації та трансрепресії (рисунок). Зв’язування активованих комплексів «ГК – ГК-рецептор» із промоторною ділянкою ГК-залежного гена призводить до підвищення синтезу регуляторних протеїнів завдяки активації транскрипції (трансактивація). При трансрепресії взаємодія комплексу «ГК – ГК-рецептор» із факторами транскрипції, як-то активаторний білок 1 і нуклеарний фактор-κВ, спричиняє зниження синтезу прозапальних протеїнів. Геномні ефекти в ядрі клітини розпочинаються вже через 30 хвилин після прийому ГК і активації комплексів «ГК – ГК-рецептор», але зазвичай для досягнення достатнього терапевтичного ефекту на органному рівні необхідно декілька днів (Stahn, 2008; Buttgereit, 2011). До недавнього часу вважалося, що протизапальні ефекти ГК головним чином базуються на механізмі трансрепресії, тоді як негативні (інфекційні та метаболічні ускладнення) – на механізмі трансактивації. На сьогодні доведено, що ключові механізми протизапальної дії ГК реалізуються через процеси трансактивації, тобто підвищення синтезу протизапальних протеїнів (Coutinho, 2011).
Негеномні ефекти реалізуються через цитозольні, мембранозв’язувальні ГК-рецептори та неспецифічну взаємодію з мембранами клітин і органел. Розвиваються вони протягом хвилин від початку застосування в дозі, вищій ніж 30 мг/добу.
Номенклатура доз
Загальноприйнятою є номенклатура доз ГК, яку було затверджено експертами Європейської антиревматичної ліги (EULAR) (Buttgereit, 2002).
Дози, визначені в еквіваленті за преднізолоном:
- низькі дози ГК ≤7,5 мг/добу;
- середні дози ГК >7,5 мг ≤30 мг/добу;
- високі дози ГК >30 мг ≤100 мг/добу;
- дуже високі дози ГК >100 мг/добу;
- пульс-терапія ≥250 мг/добу внутрішньовенно (в/в) протягом 1‑5 днів.
ГК як первинна імуносупресивна терапія
При міозитах, васкулітах та ревматичній поліміалгії ГК відіграють роль основного імуносупресивного препарату. При інших ревматологічних захворюваннях вони застосовуються як допоміжна, так звана міст-терапія, на період розвитку ефекту хворобо-модифікуючих препаратів (ХМП), або взагалі не використовуються.
Монотерапія ГК
Ревматична поліміалгія. Монотерапія ГК є обґрунтованою при ревматичній поліміалгії. Початкова доза в період індукції ремісії не повинна перевищувати 30 мг/добу та згідно з рекомендаціями EULAR (2015) знаходиться в діапазоні 12,5‑25 мг/добу в еквіваленті за преднізолоном. Після отримання терапевтичного ефекту рекомендовано знижувати дозу до 10 мг/добу протягом 4‑8 тижнів. Тривалість прийому та швидкість знижування дози в період розвитку й підтримання ремісії розраховується індивідуально залежно від активності хвороби та наявності факторів ризику ГК-асоційованих ПР. Так, наприклад, початкова доза 25 мг/добу може бути швидко знижена до 15-12,5 мг/добу, тоді як початкова доза 12,5 мг/добу – прийматись більш тривало з поступовим зниженням та відміною після досягнення ремісії. Загальноприйнятою схемою відміни ГК при ревматичній поліміалгії є зниження дози після досягнення стійкої ремісії на 1 мг 1 раз на чотири тижні або за альтернувальною схемою на 1,25 мг 1 раз на чотири тижні (10/7,5 мг через добу і далі). У разі загострення треба підвищити дозу до попереднього рівня на період 4‑8 тижнів і при стабілізації стану продовжувати зниження за стандартною схемою. За клінічної необхідності можливе додавання метотрексату (МТХ) до ГК, як на етапі індукції ремісії, так і протягом підтримуючого лікування, особливо у пацієнтів із ризиком чи наявністю загострень або ГК-асоційованих ПР (Dejaco et al., 2015).
Як альтернативу таблетованому щоденному прийому ГК у пацієнтів із високим ризиком розвитку ПР можливо використовувати метілпреднізолон (МП) внутрішньом’язово (в/м). Ефективність в/м ін’єкцій МП доведена у клінічному досліджені, але доза 120 мг для в/м введення зареєстрована не у всіх країнах, зокрема в Україні (Br J Rheumatol, 1998; Arthritis Rheum, 1997).
Гігантоклітинний артеріїт. Дотепер ГК були єдиним препаратом для лікування гігантоклітинного артеріїту (ГКА). Монотерапію високими дозами ГК застосовували зазвичай у таблетках (40‑60 мг/добу) або у вигляді пульс-терапії (у разі гострої втрати зору та розвитку загрозливих для життя ускладнень). У 2017 р. Американська та Європейська агенції з контролю за лікарськими засобами (FDA та EMEA) затвердили призначення моноклонального антитіла до інтерлейкіну 6, тоцилізумабу (ТОЦ), для лікування ГКА з метою індукції та підтримання ремісії, а також зменшення потреби у ГК. За даними дослідження GIACTA, майже втричі більше пацієнтів мали стійку ремісію на 52-му тижні при застосуванні комбінації ТОЦ + ГК порівняно із мототерапією ГК. У групі комбінованого лікування кумулятивна доза ГК була вдвічі меншою (N Engl J Med, 2017). На сьогодні, згідно з реєстраційними даними FDA та EMEA, у пацієнтів із ГКА ТОЦ рекомендовано призначати в комбінації із ГК. Після досягнення ремісії підтримуюча монотерапія ТОЦ може бути продовжена, але вона не рекомендована для лікування загострень.
При інших ревматологічних захворюваннях мототерапія ГК не рекомендована і може бути призначена лише за умов непереносимості всіх інших ХМП, як синтетичних, так і біологічних.
Ревматоїдний артрит
Незважаючи на те що протягом останнього часу погляд світової ревматологічної спільноти на використання ГК при РА значно змінився, в рутинній практиці це питання залишається невирішеним. Існують суперечливі точки зору серед лікарів і пацієнтів, зумовлені насамперед страхом розвитку ПР. З одного боку, лікарі уникають системного призначення низьких доз, а з іншого – зловживають необґрунтовано частим використанням депо-форм ГК. Така тактика не може забезпечити «лікування до досягнення мети» за сучасною концепцією, а надає лише епізодичне покращання симптомів та розвиток ПР, іноді загрозливих і необоротних.
Згідно з рекомендаціями ACR (2015) та EULAR (2016), ГК призначаються як міст-терапія на період розвитку максимального ефекту ХМП – як при первинному призначенні, так і при заміні ХМП за умов неефективності або непереносимості. Навіть при ранньому артриті, коли пацієнт ще не відповідає діагностичним критеріям жодної нозологічної форми запальних захворювань суглобів, а інші причини розвитку синовіту виключені, ГК рекомендовані як тимчасова (до шести місяців) допоміжна терапія. За наявності моно- або олігоартриту певні переваги перед системним призначенням має внутрішньосуглобове (в/с) введення ГК.
Безпечним вважається застосування низьких доз протягом певного часу (до шести місяців), необхідного для досягнення ремісії. Надають перевагу стабільному прийому таблетованих ГК перед епізодичним парентеральним застосуванням препаратів тривалої дії. В науковій літературі немає даних щодо використання бетаментазону та дексаметазону в/м для лікування РА. Не дозволене призначення ГК тривалої дії частіше ніж раз на три місяці.
Рекомендації щодо доз та тривалості прийому ГК базуються на результатах декількох сучасних досліджень при ранньому РА: tREACH (Нідерланди, 2014), CareRA (Бельгія, 2015), IDEA (Великобританія, 2014) та ESPOIR (Франція, 2017).
У дослідженні tREACH (n=281) вивчали ефективність ГК per os у дозі 15 мг/добу протягом місяця з наступним зниженням дози на 2,5 мг кожного тижня з повною відміною через 10 тижнів прийому порівняно із однократним в/м введенням 120 мг МП або 80 мг тріамцинолону. Всі пацієнти додатково приймали МТХ або комбіновану ХМТ. Мета лікування полягала у досягненні ремісії, моніторинг активності проводили кожні три місяці (de Jong, 2014).
У дослідженні CareRA (n=400) порівнювали ефективність високих (60‑40‑25‑20‑15‑10‑7,5 мг/добу/тижд) та середніх (30‑20‑12,5‑10‑7,5‑5 мг/добу/тижд) доз ГК. Після швидкого зменшення дози із початкової 60 або 30 мг/добу протягом шести тижнів до 7,5 або 5 мг/добу відповідно прийом низьких доз було продовжено до семи місяців. За дизайном дослідження CareRA комбінацію високих/середніх доз ГК із моно- або комбінованою ХМТ призначали пацієнтам високого ризику, які мали помірну/високу активність РА (DAS28>3,2) у поєднанні з серопозитивністю або наявністю ерозій. Додатково порівняльну ефективність монотерапії МТХ та комбінації МТХ + ГК вивчали у пацієнтів, які мали низьку активність РА незалежно від наявності ерозій та серопозитивності (Verschueren, 2015).
Оптимальною схемою за даними двох досліджень виявилась комбінація МТХ із низькими або середніми дозами ГК. Цільовою є доза МТХ 25 мг на тиждень, яку поступово підвищують за стандартною схемою на 2,5‑5 мг на місяць зі стартової 10‑15 мг на тиждень. Доза МТХ залежить від індивідуальної переносимості, за неможливості підвищити дозу МТХ до максимально ефективної для досягнення ремісії можна додати другий ХМП, підвищити дозу або продовжити термін прийому ГК. Аналізуючи ефективність різних схем застосування ГК, стартову дозу 15 мг/добу протягом місяця із поступовою відміною через 10 тижнів можна рекомендувати пацієнтам із помірною активністю РА без системних проявів. У разі високої активності РА, наявності системних проявів, факторів несприятливого перебігу та швидко прогресуючого ерозивного процесу після прийому стартової дози 15‑30 мг/добу доцільно проводити більш тривалу терапію ГК низькими дозами (<7,5 мг/добу до шести місяців). Використання високих доз (>30 мг/добу) не супроводжується підвищенням ефективності та викликає вдвічі більше ПР.
У дослідженні IDEA (n=112) ефективність міні-пульс-терапії (МП 250 мг в/в одноразово) порівнювали із біологічною терапією (інфліксимаб по 3 мг/кг за стандартною схемою) у терапевтично наївних пацієнтів із раннім РА (Nam, 2014). В обох групах за потреби було дозволене використання МП в/м раз на три місяці, ГК у таблетках пацієнти не приймали. Через рік результати лікування за клінічними та рентгенологічними показниками не відрізнялись, із переважанням ефекту інфліксимабу лише в перші шість тижнів. Відсутність рентгенологічного прогресування у більшості (96%) серопозитивних пацієнтів зареєстровано при лікуванні МП, тоді як у серонегативних – інфліксимабом (74%).
Питання безпеки безперервного тривалого прийому (сім років) низьких доз ГК було детально вивчене у французькому дослідженні ESPOIR на моделі рутинної клінічної практики (Roubille, 2017). За даними лікування 602 пацієнтів із раннім РА, не було виявлено різниці в кількості та якості ПР між групами хворих, які отримували (64,1%) та не отримували ГК. Середня доза ГК складала 3,1±2,9 мг/добу, середня тривалість прийому – 1057±876 днів, лише шість пацієнтів отримували ГК парентерально.
Таким чином, використання ГК у лікуванні РА є доцільним і обґрунтованим. Призначення ГК у комбінації з синтетичними ХМП на будь-якому етапі терапії РА (початок, загострення, заміна ХМП) безумовно підвищує шанси на досягнення ремісії. Продовження прийому ГК до моменту розвитку максимальної терапевтичної ефективності ХМП (шість місяців) має певні переваги перед призначенням коротких курсів за потреби (у разі загострення) (Bakker, 2012; Schett, 2016). За наявності ризику розвитку системних ПР можливо надавати перевагу парентеральному застосуванню (в/в, в/м та в/с) (Hørslev-Petersen, 2014). У разі використання біологічної терапії при ранньому РА призначення ГК не є доцільним, з одного боку, через розвиток швидкої хворобо-модифікуючої дії біологічного агента, а з другого – можливе потенціювання ризику інфекційних ускладнень (Ann Rheum Dis, 2015; Best Pract Res Clin Rheumatol, 2015). Підбиваючи підсумки, слід зазначити, що дозу, тривалість прийому, лікарську форму та шлях введення ГК у будь-якому разі визначає безпосередньо лікар з урахуванням індивідуального клінічного сценарію та даних останніх наукових досліджень і рекомендацій.
Системний червоний вовчак
У 2019 р. опубліковані новітні рекомендації з лікування СЧВ. Загальні принципи щодо використання ГК перекликаються із сучасною стратегією лікування РА і передбачають два підходи (Fanouriakis et al., 2019):
- Пульс-терапія МП у різних дозах (залежно від активності та ваги хворого), яка завдяки швидкому негеномному ефекту ГК дозволяє надалі застосовувати нижчі стартові дози ГК per os із можливістю їхнього зниження та відміни. Високі дози МП в/в (250‑1000 мг/добу три дні) зазвичай використовують у разі гострих, загрозливих для життя станів (нефрит, нейро-люпус тощо) після виключення інфекцій (Arthritis Care Res, 2018; Autoimmun Rev, 2017).
- Ініціація імуносупресивної терапії (МТХ, азатіоприн, мофетилу мікофенолат) одночасно із призначенням ГК у таблетках із метою швидкого зниження дози та їхньої відміни у подальшому.
За необхідності хронічного підтримуючого лікування ГК не рекомендовано перевищувати дозу 7,5 мг/добу. За умов ремісії та/або контролю симптомів за допомогою імуносупресивної терапії бажано відмінити ГК. За наявності персистуючої активності або загострення позаниркових проявів необхідно вирішити питання про призначення белімумабу; у разі рефрактерного перебігу та тяжкого органного ураження можна призначати ритуксимаб.
АНЦА-васкуліти
Починаючи із 2014 р., чотири наукових товариства створюють та постійно переглядають рекомендації щодо менеджменту АНЦА-васкулітів на основі сучасних даних доказової медицини:
- Британське товариство ревматологів (BSR/BHPR, 2014);
- Канадське наукове товариство з вивчення васкулітів (Can Vasc, 2016);
- Європейська антиревматична ліга / Європейська ниркова асоціація та Європейська асоціація діалізу і трансплантації (EULAR/ERA-EDTA, 2015);
- Бразильське товариство ревматологів (SBR, 2017).
Згідно зі всіма рекомендаціями, ГК є першою лінією терапії АНЦА-васкулітів. Тяжке захворювання потребує початкового призначення пульс-терапії МП по 250‑500 мг у поєднанні з циклофосфамідом 1 раз на два тижні № 2 (BSR/BHPR) або 500‑1000 мг/добу № 3 за наявності станів, загрозливих для життя (CanVasc). Рекомендації EULAR не містять специфічної інформації щодо використання пульс-терапії і регламентують початкове призначення ГК у таблетках в дозах 0,5‑1 мг/кг/добу за преднізолоном із максимумом 60‑80 мг/добу.
Дискутованим є питання швидкості зниження дози ГК. Відповідно до даних останніх досліджень RAVE та RITUXVAS, за рекомендаціями CanVasc максимальна тривалість високодозової (1 мг/кг/добу) терапії ГК не повинна перевищувати один місяць, а згідно зі стандартами SBR її тривалість складає від 1 до 4 тижнів (N Engl J Med, 2010). За рекомендаціями EULAR/ERA-EDTA та BSR/BHPR знизити дозу ГК до 10‑15 мг/добу необхідно через 12 тижнів лікування. SBR вважає за потрібне зменшувати дозу на 10 мг кожні 2‑4 тижні до 20 мг/добу, потім – на 2,5‑5 мг кожні 2‑4 тижні до повної відміни.
Не існує єдиної точки зору щодо загальної тривалості підтримуючого лікування низькими дозами ГК при АНЦА-васкулітах. Експерти CanVasc та EULAR відмічають відсутність доказової бази щодо цього пункту. SBR визначили шість місяців як мінімальну тривалість терапії ГК, що може бути продовжено до 1‑2 років за клінічної потреби. Згідно зі всіма рекомендаціями, у пацієнтів із загостреннями варто продовжувати прийом ГК на термін, необхідний для досягнення ремісії хвороби.
Вибір ГК для тривалого застосування
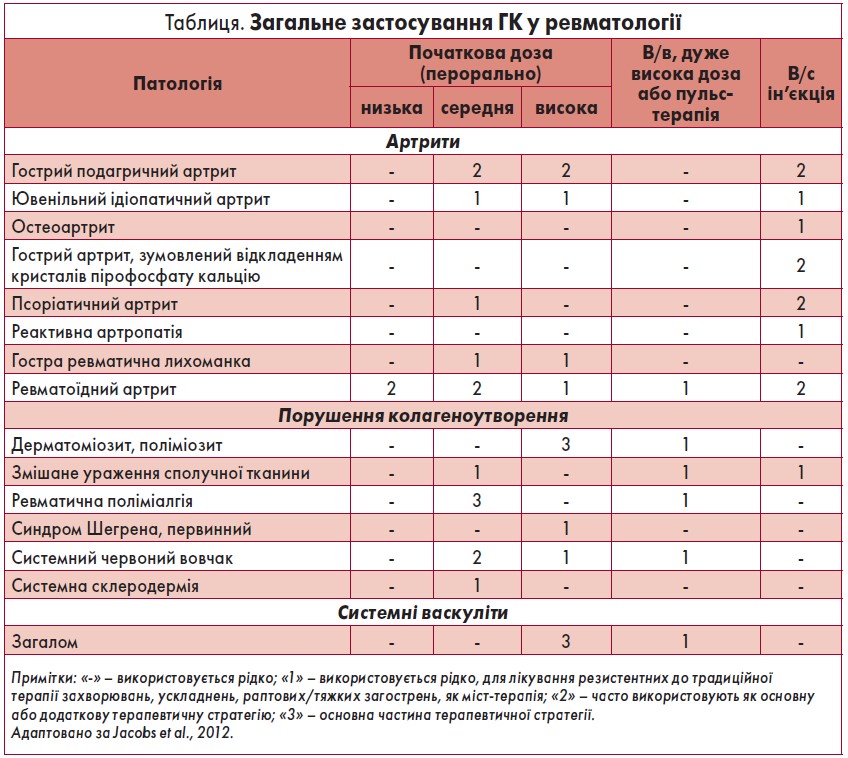
Таким чином, на сьогодні ГК є невід’ємною частиною новітньої терапевтичної стратегії «лікування до досягнення мети». Вони показані для індукції ремісії майже при всіх РЗ (таблиця). Рекомендовано застосовувати ГК як міст-терапію на період розвитку максимальної ефективності ХМП, включно з імуносупресивними агентами та біологічною терапією при васкулітах, СЧВ й інших системних захворюваннях. Після досягнення ремісії необхідно поступово знизити дозу та відмінити ГК. За неможливості відмінити ГК слід переглянути стратегію призначення ХМП. Профілактикою розвитку ПР є призначення ГК коротким курсом у найменшій дозі, яка дозволяє контролювати симптоми та вибір оптимального препарату.
Доведено, що системного застосування ГК протягом трьох тижнів достатньо для супресії ГГНС. Це стосується не лише прийому ГК у таблетках, але й парентерального введення депо-препаратів ГК (бетаметазон, тріамцинолон), строк дії яких у середньому становить чотири тижні.
Розвиток синдрому Кушинга, який включає широкий спектр патологічних симптомів, напряму залежить від ступеня супресії ГГНС. Ступінь супресії ГГНС має кореляцію із силою протизапальної активності препарату, чим вища активність, тим більша супрессія. Протизапальна активність є відносною величиною і відображає, у скільки разів синтетичний ГК перевищує активність ендогенного кортизолу. Так, сила негеномних ефектів преднізолону перевищує такі кортизолу в чотири рази, МП – у п’ять разів, бетаметазону та дексаметазону – в 25 разів. Тому при використанні бетаметазону і дексаметазону з метою тривалої системної терапії ПР переважають над ефективністю. Необхідно зазначити, що прийом бетаметазону частіше ніж 1 раз на три місяці, а дексаметазону – курсами в/в або в/м 3‑4 рази на рік вже є системним лікуванням. Розвиток ПР залежить також від періоду напіввиведення препарату. ГК тривалої дії (36‑72 години) за рахунок постійної стимуляції ГК-рецепторів периферичних тканин у менших дозах і термінах прийому викликають супресію ГГНС (Paragliola, 2017).
Оптимальними медикаментами для системної протизапальної терапії є преднізолон та метилпреднізолон. Недоліком преднізолону є майже відсутність геномних ефектів (перевищує такі кортизолу лише у чотири рази), що унеможливлює проведення пульс-терапії цим препаратом. Протизапальний ефект МП перевищує преднізолон та має унікальне співвідношення негеномних і геномних ефектів: 5 та 13.3 (порівняно із кортизолом). Такий баланс дозволяє уникати значної супресії ГГНС при тривалому системному прийомі низьких доз, а саме знижувати силу та спектр ПР, і надає можливість проводити пульс-терапію. Співвідношення ж негеномних/геномних ефектів для дексаметазону складає 25/20, а для бетаметазону – 25/<2,7, що наглядно демонструє недоліки цих препаратів для проведення системного протизапального лікування ревматичних захворювань. Застосування дексаметазону має певні переваги у невідкладній медицині, а показанням для призначення бетаметазону є ін’єкції в/с.
Представником оригінального МП на вітчизняному фармринку є препарат Медрол (компанія Pfizer, США). Різні форми випуску дозволяють проводити системне протизапальне лікування в таблетках, застосовувати пульс-терапію при гострих епізодах тяжких ревматологічних захворювань та їхніх ускладненнях і за потреби проводити ін’єкції в/с та в/м із метою зниження кумулятивної дози системної терапії пацієнтам з моно-, олігоартритами.
Стаття друкується за підтримки Представництва «Пфайзер Експорт Бі Ві» в Україні
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (64) червень 2019 р.
СТАТТІ ЗА ТЕМОЮ Ревматологія
У практиці сімейного лікаря досить часто зустрічаються випадки звернення по допомогу осіб із суглобовим синдромом, що актуалізує питання доказового ведення таких пацієнтів. Остеоартрит (ОА) – найпоширеніша форма артриту з хронічним болем та функціональними порушеннями. Пропонуємо до вашої уваги огляд доповіді, яку представив у межах конференції «Щоденник сімейного лікаря: клінічні історії пацієнтів» завідувач кафедри сімейної медицини і амбулаторної допомоги медичного факультету № 2 Ужгородського національного університету, к.мед.н. Павло Олегович Колесник. ...
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....