Роль пембролізумабу у лікуванні раку нирки: висновки ASCO-2023
У структурі онкозахворюваності у світі рак нирки посідає 13-те місце, щороку кількість нових випадків цього захворювання складає понад 330 тис. Поширеність раку нирки значно вища у країнах Європи, Північної Америки, Австралії/Новій Зеландії та Японії. Захворюваність на рак нирки неухильно зростає з віком: половину випадків виявляють у віці до 65 років. Захворюваність у чоловіків удвічі вища, ніж у жінок. Етіологія раку нирки в цілому залишається невідомою. Однак сьогодні з’ясовано, що відмова від куріння, дотримання принципів здорового харчування та контроль рівня артеріального тиску дозволяють знизити ризик розвитку хвороби (G. Scelo et al., 2018). У рамках щорічної зустрічі Американського товариства клінічної онкології (ASCO), яка відбулася 2-6 червня у м. Чикаго (США), активно обговорювалася тема підвищення ефективності лікування раку нирки. Широко вивчалася проблема пошуку нових методів подовження виживаності пацієнтів з раком нирки, при цьому велика кількість доповідей була присвячена новим даним, отриманим під час тривалого спостереження хворих на світлоклітинну нирковоклітинну карциному (НКК). Жваво обговорювалися також нещодавно отримані результати щодо ефективності застосування пембролізумабу у хворих на поширену НКК та пацієнтів з НКК після нефректомії, в яких продовжує зберігатися підвищений ризик розвитку рецидиву захворювання.
В останні роки було проведено кілька досліджень, які демонструють переваги застосування імунотерапії у комбінації з таргетними препаратами (пембролізумаб + акситиніб) над стандартною таргетною терапією (сунітиніб). Так, у рамках дослідження III фази KEYNOTE-426 на етапі медіани спостереження тривалістю 12,8 місяця були висвітлені перші результати проміжного аналізу ефективності використання пембролізумабу у поєднанні з акситинібом порівняно із призначенням сунітинібу у пацієнтів з поширеною світлоклітинною НКК, які раніше не отримували лікування з приводу цього захворювання. Було показано, що на момент аналізу даних частка пацієнтів, які залишилися живими після отриманого лікування, становила 89,9% у групі пембролізумабу з акситинібом та 78,3% – сунітинібу (відношення ризиків – ВР – становило 0,53; 95% довірчий інтервал – ДІ – 0,38-0,74; p<0,0001). Медіани загальної виживаності (ЗВ) не було досягнуто в обох групах (ВР 0,53; 95% ДІ 0,38-0,74; p<0,0001), однак медіана виживаності без прогресування (ВБП) у групі пембролізумабу з акситинібом склала 15,1 проти 11,1 місяця у групі сунітинібу (ВР 0,69; 95% ДІ 0,57-0,84; p<0,001). Загальна частота відповіді (ЗЧВ) була достовірно вищою у пацієнтів, що приймали пембролізумаб, ніж у хворих, які отримували сунітиніб (59,3 проти 35,7%; p<0,001; B.I. Rini et al., 2019). Переваги застосування пембролізумабу у комбінації з акситинібом над сунітинібом чітко простежувалися при подовженому спостереженні (медіана тривалості спостереження 30,6 місяця; T. Powles et al., 2020) та на завершальному етапі аналізу даних (медіана тривалості спостереження – 42,8 місяця; B.I. Rini et al., 2021). На основі отриманих у вищезазначених дослідженнях даних вивчення ефективності пембролізумабу було продовжено у наступних клінічних випробуваннях.
У рамках ASCO-2023 було представлено результати 5-річного аналізу дослідження KEYNOTE-426 щодо порівняння ефективності застосування пембролізумабу з акситинібом проти сунітинібу у першій лінії терапії пацієнтів з поширеною світлоклітинною НКК. Ключовими критеріями включення хворих у дослідження були вперше діагностована або рецидивуюча світлоклітинна НКК IV стадії, відсутність в анамнезі системного лікування з приводу поширеного захворювання та відповідність захворювання критеріям оцінки відповіді на лікування при солідних пухлинах (RECIST, версія 1.1). Стратифікацію проводили за визначенням груп ризику за шкалою Міжнародного консорціуму з метастатичного нирковоклітинного раку (International Metastatic RCC Database Consortium, IMDC) та належністю пацієнтів до відповідного географічного регіону (Північна Америка, Західна Європа чи інші країни).
Усіх учасників дослідження (n=861) було рандомізовано у співвідношенні 1:1 у групу отримання пембролізумабу у дозі 200 мг внутрішньовенно через кожні 3 тижні до 35 циклів (тривалість лікування складала приблизно 2 роки) у поєднанні з акситинібом у дозі 5 мг перорально 2 рази на добу (1-ша група) та у сунітинібу у дозі 50 мг перорально 1 раз на добу протягом перших 4 тижнів кожного 6-тижневого циклу (2-га група).
Подвійними первинними кінцевими точками були ЗВ і ВБП, а вторинними – визначення ЗЧВ і тривалості відповіді на лікування відповідно до RECIST 1.1 за оцінкою незалежного контрольного комітету у засліпленому режимі (BIRC).
Ефективність лікування визначали в усіх рандомізованих пацієнтів. Було проведено спеціальний аналіз для формування гіпотези за ЗВ з використанням двоетапного методу розрахунку з метою оцінки потенційного впливу подальшої протипухлинної терапії на виживаність (N.R. Latimer et al., 2017; K. Skaltsa et al., 2017). При цьому не було проведено жодного формального тестування гіпотези, оскільки статистично значущі переваги щодо ЗВ, ВБП і ЗЧВ у групі пембролізумабу з акситинібом були досягнуті у першому проміжному аналізі. У цьому клінічному дослідженні ВБП, ЗВ і ЗЧВ оцінювалися у пацієнтів, які повністю пройшли усі 35 циклів (2 роки) лікування пембролізумабом. Медіана ВБП була вищою у групі пембролізумабу з акситинібом та склала 15,7 (13,6-20,2) місяця, у групі сунітинібу – 11,1 (8,9-12,5) місяця (ВР 0,69; 95% ДІ 0,59-0,81), що свідчить про переваги застосування пембролізумабу у поєднанні з акситинібом. 60-місячна ВБП становила 18,3% у 1-й групі проти 7,3% у 2-й групі (рис. 1).
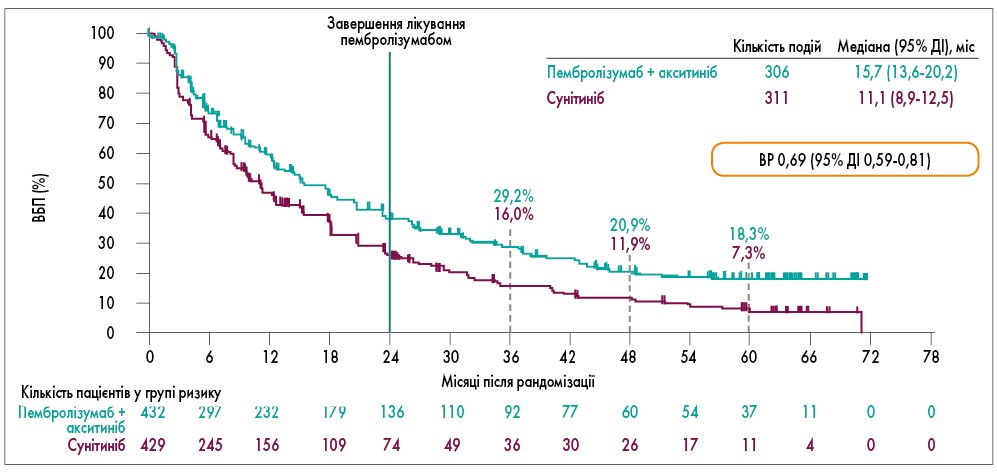 Рис. 1. ВБП в ІТТ-популяції (усі рандомізовані пацієнти, які отримали щонайменше одну дозу лікування) у дослідженні KEYNOTE-426
Рис. 1. ВБП в ІТТ-популяції (усі рандомізовані пацієнти, які отримали щонайменше одну дозу лікування) у дослідженні KEYNOTE-426
ЗЧВ дорівнювала 60,7% у хворих, які отримували пембролізумаб з акситинібом, та 39,7% у пацієнтів, які приймали сунітиніб. Медіана тривалості відповіді становила 23,6 (95% ДІ 1,4-68,6) місяця у групі пембролізумабу з акситинібом та 15,3 (95% ДІ 2,3-68,3) місяця у групі сунітинібу. Перевага застосування пембролізумабу у комбінації з акситинібом відзначалася й щодо медіани ЗВ, яка у цій групі склала 47,2 (95% ДІ 43,6-54,8) місяця, порівняно з групою сунітинібу – 40,8 (95% ДІ 34,3-47,5) місяця (ВР 0,84; 95% ДІ 0,71-0,99). 60-місячна ЗВ становила 41,9% у 1-й групі проти 37,1% у 2-й групі (рис. 2).
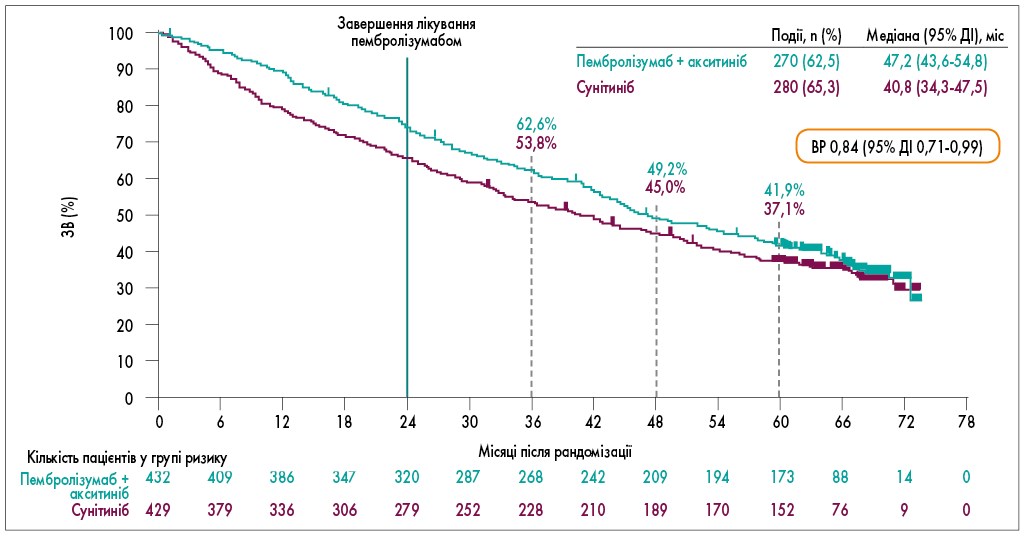 Рис. 2. ЗВ в ІТТ-популяції у дослідженні KEYNOTE-426
Рис. 2. ЗВ в ІТТ-популяції у дослідженні KEYNOTE-426
Серед пацієнтів групи низького ризику за шкалою IMDC не спостерігалося статистично значущої різниці щодо ВБП у групах пембролізумабу з акситинібом та сунітинібу (ВР 0,76; 95% ДІ 0,57-1,02). Проте ЗЧВ у пацієнтів, які отримували пембролізумаб з акситинібом, була вищою та склала 68,8% порівняно з хворими, яким призначали сунітиніб, – 50,4%. У пацієнтів групи проміжного/високого ризику за шкалою IMDC виявлена значна перевага щодо ВБП при застосуванні пембролізумабу з акситинібом порівняно з використанням сунітинібу (ВР 0,68; 95% ДІ 0,56-0,82). Перевага спостерігалася й щодо ЗЧВ, яка у 1-й групі склала 56,8%, а у 2-й – 34,9%.
Серед пацієнтів, які припинили лікування, 62,2% хворих групи пембролізумабу з акситинібом та 73,9% пацієнтів групи сунітинібу отримували подальшу протипухлинну терапію. Найчастіше пацієнтам призначали інгібітори фактора росту ендотелію судин (VEGF/VEGFR) – 86,9% хворим 1-ї та 72,0% пацієнтам 2-ї групи. При врахуванні поправки на подальшу терапію з використанням двоетапного методу розрахунку коефіцієнт ризику ЗВ становив 0,67 (95% ДІ 0,52-0,84).
120 (27,8%) пацієнтів завершили 35 циклів лікування пембролізумабом. У цій групі 36-місячна ЗВ становила 94,2%, а 60-місячна – 70,7%, при цьому медіани ЗВ не було досягнуто (95% ДІ 70,6 – не досягнуто – НД). 36-місячна ВБП становила 55,2%, 60-місячна – 32,8%, а медіана ВБП – 37,4 місяця (95% ДІ 32,3-43,7).
Дослідження KEYNOTE-426 сьогодні є найтривалішим спостереженням щодо ефективності застосування інгібітора контрольних точок у комбінації з інгібітором рецепторів тирозинкінази VEGF як першої лінії терапії світлоклітинної НКК. Комбінація пембролізумабу з акситинібом продовжує забезпечувати кращі показники ЗВ, ВБП і ЗЧВ порівняно з сунітинібом у пацієнтів зі світлоклітинною НКК, які раніше не отримували лікування з приводу цього захворювання.
Перевага комбінації пембролізумабу з акситинібом відмічалася попри наявність у групі сунітинібу більшої частки пацієнтів, які отримували подальшу терапію, що включала переважно інгібітори PD-1/L1, та в цілому більше ліній терапії. Значна частина пацієнтів повністю пройшла 35 циклів лікування пембролізумабом із задовільними віддаленими результатами. Ці дані свідчать про переваги застосування пембролізумабу у поєднанні з акситинібом як стандартної терапії у пацієнтів із поширеною світлоклітинною НКК, які раніше не отримували лікування з приводу цього захворювання (B.I. Rini et al., 2023).
Іншою актуальною проблемою, яка активно обговорювалася у рамках ASCO-2023, був пошук ефективної терапії НКК після нефректомії, оскільки протягом останніх 30 років клінічних досліджень не досягнуто успіху у напрямі подовження виживаності пацієнтів. Останніми роками активно вивчали застосування інгібіторів тирозинкінази в ад’ювантному режимі у пацієнтів з НКК після нефректомії, однак застосування акситинібу, пазопанібу і сорафенібу неістотно вплинуло на підвищення ефективності ад’ювантної терапії. Отримання пацієнтами сунітинібу супроводжувалося суперечливими результатами щодо виживаності без ознак захворювання (DFS) у рандомізованих дослідженнях III фази. При цьому у жодному з клінічних досліджень не спостерігалося покращення ЗВ (N.B. Haas et al., 2016; 2017; A. Ravaud et al., 2016; R.J. Motzer et al., 2017). Тому більшість пацієнтів з НКК перебувають на клінічному спостереженні або беруть участь у клінічних дослідженнях. Проте у хворих, яким була проведена нефректомія з приводу НКК, найвищий ризик рецидиву спостерігається протягом 5 років після операції (J.M. Speed et al., 2017). У літературі описано, що приблизно у 26% пацієнтів зі стадією Т2, 50% зі стадією Т3 і майже у всіх пацієнтів зі стадією Т4 спостерігається рецидив після нефректомії (J.M. Speed et al., 2017; A. Breda et al., 2007). Крім того, пухлини вищого ступеня градації ядра пухлинної клітини за Фурманом та з наявністю саркоматоїдних ознак також належать до групи підвищеного ризику розвитку рецидиву (B.C. Leibovich et al., 2013; S.A. Fuhrman et al., 1982).
Іншою групою пацієнтів, яким може бути корисна ад’ювантна терапія, є хворі з резектабельними метастазами у м’яких тканинах на момент діагностики (стадія М1) при первинній пухлині нирок. Пацієнти, яким було успішно виконано нефректомію та повну метастазектомію, вважаються такими, що не мають ознак захворювання, проте у них зберігається високий ризик рецидиву та смерті протягом 5 років після операції (T. Powles et al., 2022).
З метою вивчення ад’ювантної монотерапії пембролізумабом порівняно з плацебо після нефректомії у пацієнтів з локалізованою НКК або після нефректомії та метастазектомії у хворих з НКК стадії М1 було проведено рандомізоване подвійне сліпе плацебо-контрольоване дослідження III фази KEYNOTE-564. Перший проміжний аналіз даних дослідження, проведений приблизно через 24 місяці спостереження, засвідчив, що ад’ювантне застосування пембролізумабу сприяло статистично значущому покращенню DFS порівняно з плацебо у пацієнтів зі світлоклітинною НКК та високим ризиком розвитку рецидиву. Через 6 місяців спостереження проведено подальший аналіз результатів з метою довгострокової оцінки ефективності та безпеки пембролізумабу порівняно з плацебо.
Дослідження KEYNOTE-564 охопило широку популяцію пацієнтів з різними характеристиками захворювання, асоційованими з різними ризиками рецидиву раку, визначеними на основі системи класифікації Американського об’єднаного комітету з раку (AJCC), градації ядра пухлинної клітини за Фурманом та ступеня ураження лімфатичних вузлів. З метою прогнозування 5-річної виживаності після нефректомії використовували інтегровану систему визначення стадій для карциноми нирок Каліфорнійського університету в Лос-Анджелесі (UISS), яка є прогностичною моделлю, що враховує розмір первинної пухлини (T), ступінь залучення лімфатичних вузлів (N), наявність метастазів (M), градацію ядра пухлинної клітини за Фурманом та критерії ефективності Східної кооперативної онкологічної групи (ECOG PS; A. Zisman et al., 2002). Критеріями включення у дослідження були наявність гістологічно підтвердженої світлоклітинної НКК групи проміжного (pT2 4 ступеня або саркоматоїд без ураження лімфатичних вузлів (N0) і без метастазів (M0) чи pT3 будь-якого ступеня N0M0) чи високого (pT4 будь-якого ступеня N0M0; або pT будь-якої стадії чи ступеня N+M0) ризику розвитку рецидиву захворювання, відсутність в анамнезі системної терапії та попередньо проведена нефректомія щонайменше за 12 тижнів до рандомізації.
У клінічне дослідження також включали пацієнтів з метастазами, які були видалені протягом 1 року після нефректомії (М1 NED), без ознак захворювання. Відповідні учасники мали 0 або 1 бал за шкалою ECOG. Cтратифікацію було проведено за наявністю M1 NED чи M0. Останню групу було додатково стратифіковано за шкалою ECOG (0 проти 1 бала) та належністю до окремого географічного регіону (США). Усіх учасників дослідження (n=994) було рандомізовано у співвідношенні 1:1 у групу прийому пембролізумабу у дозі 200 мг внутрішньовенно через кожні 3 тижні до 17 циклів (тривалість лікування складала приблизно 1 рік) або плацебо з такою самою частотою та кількістю циклів. Модифікацію дози пембролізумабу не проводили. Рішення про припинення прийому досліджуваного препарату вважалося остаточним, а повторне лікування у цій групі пацієнтів не дозволялося.
Кінцевими точками дослідження були DFS та виживаність без віддалених метастазів (DMFS), оцінені у групах ризику за UISS та класифікацією TNM. Кінцевою датою збору даних було 14 червня 2021 р. Медіана спостереження склала 30,1 місяця (95% ДІ 20,8-47,5).
При аналізі розподілу хворих за UISS приблизно 75% пацієнтів у кожній з груп отримуваного лікування мали проміжний ризик, при цьому 5,9% склали хворі з M1 NED. Майже 88% пацієнтів у кожній з досліджуваних груп мали III стадію захворювання за AJCC. Крім того, хворі з високим ризиком рецидиву за UISS рідше мали ECOG PS 0 порівняно з групою проміжного ризику (32,6-34,0 проти 99,2-99,4%). Наявність N1 спостерігалася у 26,3-29,0% хворих групи високого ризику, тоді як у групі проміжного ризику за UISS стадії N1 не було. Тобто групи лікування були добре збалансовані за початковими характеристиками.
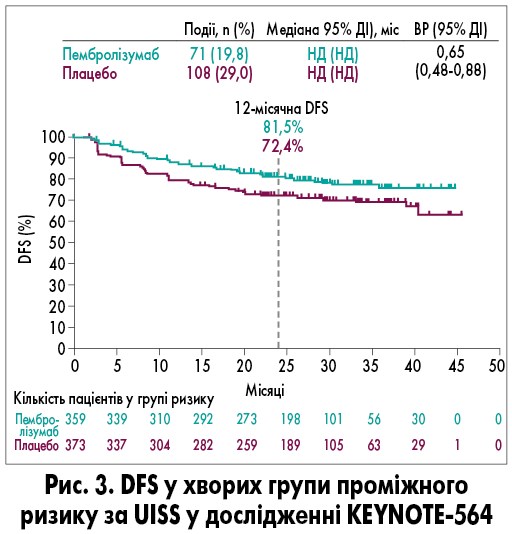 Серед учасників, які отримали принаймні одну дозу досліджуваного препарату, 298 (61%) із 488 пацієнтів групи пембролізумабу та 366 (74%) із 496 хворих групи плацебо завершили всі 17 запланованих циклів лікування. Найпоширенішою причиною припинення лікування був розвиток побічних явищ (ПЯ; у 105 (22%) із 488 учасників групи пембролізумабу проти 11 (2%) із 496 пацієнтів групи плацебо) та рецидив захворювання (у 51 (10%) із 488 учасників групи пембролізумабу проти 101 (20%) із 496 пацієнтів групи плацебо). У групі проміжного ризику за UISS у хворих, які отримували пембролізумаб чи плацебо, медіани DFS не було досягнуто (ВР 0,65; 95% ДІ 0,48-0,88), при цьому 24-місячна DFS склала 81,5 та 72,4% відповідно (рис. 3).
Серед учасників, які отримали принаймні одну дозу досліджуваного препарату, 298 (61%) із 488 пацієнтів групи пембролізумабу та 366 (74%) із 496 хворих групи плацебо завершили всі 17 запланованих циклів лікування. Найпоширенішою причиною припинення лікування був розвиток побічних явищ (ПЯ; у 105 (22%) із 488 учасників групи пембролізумабу проти 11 (2%) із 496 пацієнтів групи плацебо) та рецидив захворювання (у 51 (10%) із 488 учасників групи пембролізумабу проти 101 (20%) із 496 пацієнтів групи плацебо). У групі проміжного ризику за UISS у хворих, які отримували пембролізумаб чи плацебо, медіани DFS не було досягнуто (ВР 0,65; 95% ДІ 0,48-0,88), при цьому 24-місячна DFS склала 81,5 та 72,4% відповідно (рис. 3).
Медіана DFS у групі високого ризику не була досягнута у хворих, які отримували пембролізумаб, та склала 40,5 місяця (95% ДІ 19,4 – НД) у групі плацебо (ВР 0,77; 95% ДІ 0,49-1,2). При цьому 24-місячна DFS склала 65,0% у хворих групи пембролізумабу проти 55,9% у пацієнтів групи плацебо (рис. 4). 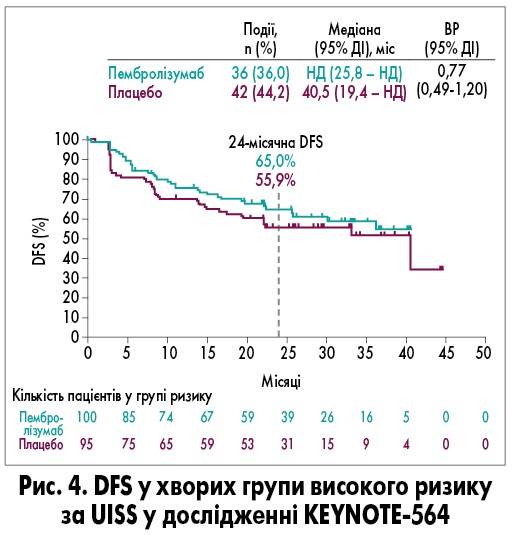
У групі хворих з M1 NED, які отримували пембролізумаб, медіани DFS не було досягнуто, тоді як у пацієнтів групи плацебо вона склала 11,6 місяця (95% ДІ 5,6 – НД; ВР 0,28; 95% ДІ 0,12-0,66; рис. 5).
При цьому 24-місячна DFS у хворих, які отримували пембролізумаб, становила 78,4%, а у пацієнтів, яким призначали плацебо, – 37,9%. Подібно до DFS, перевага ад’ювантного застосування пембролізумабу проти плацебо щодо DMFS спостерігалася у підгрупах проміжного (ВР 0,65; 95% ДІ 0,47-0,88), високого (ВР 0,79; 95% ДІ 0,49-1,26) ризику та M1 NED (ВР 0,28; 95% ДІ 0,11-0,73). Користь пембролізумабу в ад’ювантній терапії щодо DMFS була найбільш вираженою у пацієнтів із III (ВР 0,68; 95% ДІ 0,51-0,89) та IV (ВР 0,42; 95% ДІ 0,20-0,87) стадіями за AJCC. Найпоширенішими ПЯ 3-4 ступеня тяжкості були артеріальна гіпертензія (у 14 (3%) із 496 учасників), підвищення рівня аланінамінотрансферази (в 11 (2%) із 496 пацієнтів) у групі пембролізумабу та артеріальна гіпертензія (у 13 (3%) з 498 учасників) у групі плацебо. Серйозні ПЯ, пов’язані з досліджуваним лікуванням, виникли у 59 (12%) учасників у групі пембролізумабу та в одного (<1%) учасника в групі плацебо.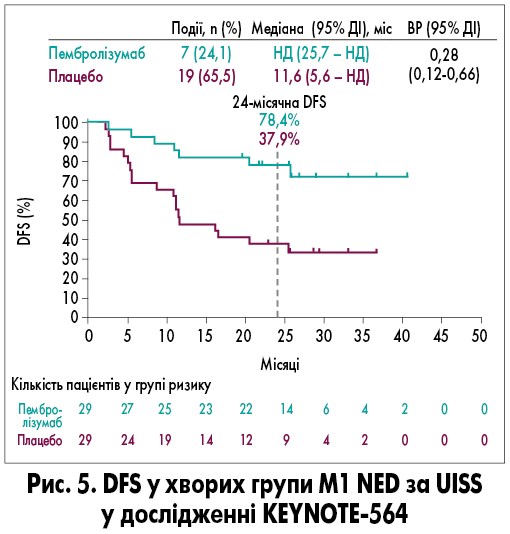
Дослідники відзначили, що більшість пацієнтів у групах пембролізумабу (73,6%) і плацебо (75,1%) належали до групи проміжного ризику за UISS. Використання пембролізумабу в ад’ювантному режимі подовжувало DFS і DMFS порівняно з плацебо в підгрупах ризику за UISS, стадіями AJCC, статусом TNM та градацією ядра пухлинної клітини за Фурманом. Отже, результати цього клінічного дослідження демонструють переваги ад’ювантного прийому пембролізумабу після нефректомії як стандартного лікування пацієнтів із НКК із підвищеним ризиком рецидиву (T.K. Choueiri et al., 2023).
Таким чином, результати тривалих досліджень KEYNOTE-426 та KEYNOTE-564, проведених за участю широкої популяції пацієнтів зі світлоклітинною НКК та різними характеристиками захворювання, свідчать про переваги застосування пембролізумабу щодо подовження виживаності, особливо у пацієнтів групи високого ризику рецидиву.
Підготувала Ірина Пікалюк
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 3 (82) 2023 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
У лютому відбулася щорічна Всеукраїнська науково-практична конференція «Малоінвазивні технології в урології», присвячена актуальним проблемам сучасної урології. Пропонуємо огляд найцікавіших доповідей, що прозвучали в рамках заходу....
Інфекції сечовивідних шляхів (ІСШ) у всьому світі посідають провідне місце серед інфекційних захворювань дорослого населення. Поряд із тим серед фахівців зростає занепокоєння щодо триваючого зростання стійкості бактерій до більшості антибіотиків. Експерти провідних міжнародних товариств наголошують на необхідності розсудливого і виваженого призначення антимікробних препаратів. Про основні принципи раціональної антибіотикотерапії в урології, зокрема при проведенні діагностичних і хірургічних втручань, ми попросили розповісти завідувача відділу відновної урології та новітніх технологій ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», доктора медичних наук, професора В’ячеслава Миколайовича Григоренка. ...
Процедура трансректальної біопсії простати супроводжується високим ризиком інфекційних ускладнень, тому проведення антимікробної профілактики при цьому втручанні є обов’язковим. Однак зростання антибіотикорезистентності, а також нещодавні рекомендації щодо обмеження призначень фторхінолонів значно звужують спектр можливих варіантів такої профілактики. Міжнародною мультидисциплінарною групою експертів на основі літературних джерел та клінічного досвіду було розроблено ряд настанов стосовно запобігання інфекційним ускладненням при біопсії простати та обґрунтовано доцільність і переваги призначення з цією метою фосфоміцину ...
Кількість людей, які страждають і помирають від вірусного гепатиту В (ВГВ), можна порівняти з кількістю хворих на коронавірусну хворобу 2019 року (COVID‑19), яка наразі викликає велике занепокоєння в усьому світі. Тому вкрай важливим залишається питання передачі вірусу, у тому числі через статеві клітини. Попередніми дослідженнями встановлено, що гени ВГВ, інтегровані в людські сперматозоїди, здатні до реплікації та експресії після передачі ембріонам. Однак досі це явище не було підтверджено клінічними дослідженнями у пацієнтів. Автори вивчали особливості інтеграції ВГВ у геном сперматозоїдів пацієнтів та аналізували можливі клінічні наслідки для потомства ...




