Препараты выбора для профилактики и лечения интраабдоминальных инфекций в хирургической практике

Антибиотикорезистентность, по заявлению ВОЗ, является на сегодняшний день одной из наиболее серьезных угроз для здоровья человечества, приводящей к увеличению сроков госпитализации, затрат на лечение и росту летальности от заболеваний, вызванных бактериальными инфекциями. ВОЗ призывает соблюдать общие принципы рациональной антибиотикотерапии во всех отраслях медицины и соотносить желаемый терапевтический эффект с возможными осложнениями для пациента, в связи с чем был составлен перечень критически важных противомикробных препаратов.
В 2017 году ВОЗ был проведен обзор основных лекарственных средств (ОЛС), а в частности – раздела, посвященного антибактериальным препаратам. В рамках глобального плана действий по борьбе с антибиотикорезистентностью была разработана программа оптимизации применения противомикробных средств. Комитет экспертов предложил подразделить все антибиотики на три категории – доступа, наблюдения и резерва.
! Цефалоспорины 3-го поколения, как с ингибитором бета-лактамазы (цефоперазон, цефоперазон/сульбактам, цефтриаксон, цефтриаксон/сульбактам, цефотаксим), так и без него, относятся к группе наблюдения. В нее входят классы антибиотиков, вызывающие более позднее формирование резистентности, которые рекомендуются в качестве препаратов первого или второго выбора и имеют определенный перечень показаний [1].
Термин «интраабдоминальная инфекция» (ИАИ) используют для обозначения широкого спектра инфекций, которые, как правило, вызываются микроорганизмами, колонизирующими желудочно-кишечный тракт (ЖКТ) и проникающими в другие, обычно стерильные, области брюшной полости [2]. Актуальность проблемы ИАИ определяется тем, что большинство из них относятся к жизнеугрожающим состояниям, они являются основной причиной ургентной госпитализации в хирургические стационары. Зарубежные специалисты придерживаются классификации, предложенной в 2009 году F. Menichetti и G. Sganga, согласно которой ИАИ подразделяется на вне- и внутрибольничную, в которой, в свою очередь, выделяют послеоперационную и непослеоперационную.
При неосложненных инфекциях отсутствуют признаки перитонита и выраженной системной воспалительной реакции, они не требуют длительной антибактериальной терапии после операции, и в этом случае достаточно периоперационной антибиотикопрофилактики. Осложненные инфекции характеризуются той особенностью, что инфекционный процесс распространяется за пределы зоны его возникновения, вызывая развитие перитонита и сепсиса или формирование абсцесса в брюшной полости либо в забрюшинном пространстве. В последние годы резко увеличилось число больных с инфицированными формами панкреонекроза, аппендицитом, прободением ЖКТ, перитонитом различной этиологии. К развитию перитонита чаще всего приводит перфорация полого органа ЖКТ: желудка и двенадцатиперстной кишки (30%), аппендикса (20-25%), поражения толстой кишки (20%), тонкой кишки (около 15%) [4]. Летальность, причиной которой является развитие сепсиса, при этих заболеваниях остается высокой.
Интраабдоминальные инфекции являются одними из самых частых осложнений онкологических заболеваний органов брюшной полости. Так, в США ежегодно регистрируют до 140 тыс. случаев рака толстой кишки, при этом в 2,6-10% случаев развивается перитонит или абсцесс брюшной полости [5, 6].
Проведение рациональной антибактериальной терапии, являющейся важным компонентом в комплексном лечении ИАИ, в современных условиях широкого распространения антибиотикорезистентности является сложной задачей. Основой для выбора схем антибактериальной терапии служат данные о микробиологической активности препаратов, их переносимости и фармакокинетике. Абсолютно необходимым является также подтверждение клинической эффективности схем лечения в контролируемых клинических испытаниях. Решающую роль для результатов комплексного лечения играет адекватная эмпирическая терапия, т. е. терапия до получения результатов бактериологического исследования у конкретного пациента. Вполне очевидно, что схемы эмпирической терапии по своему действию должны охватывать максимально широкий спектр возможных этиологических агентов и обеспечивать высокую активность в отношении антибиотикорезистентных микроорганизмов.
Защищенные пенициллины, фторхинолоны, цефалоспорины 2-4-го поколений, аминогликозиды, карбапенемы являются препаратами выбора в терапии острой хирургической патологии и послеоперационных гнойно-септических осложнений. Вместе с тем данные литературы свидетельствуют о сравнимой эффективности большинства цефалоспоринов.
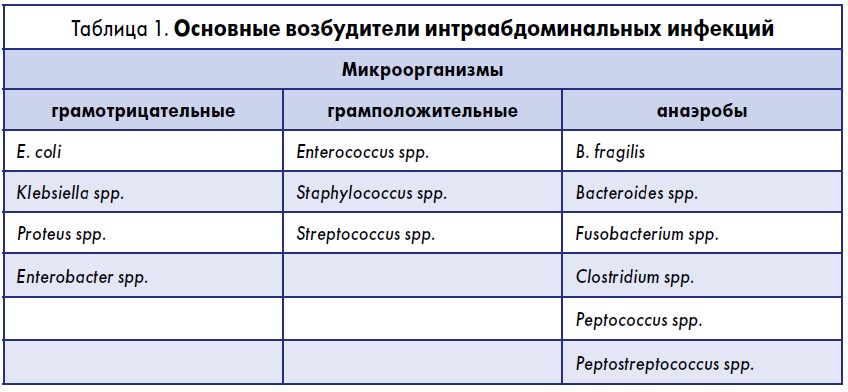
Среди современных цефалоспоринов с расширенным антибактериальным спектром обращает на себя внимание цефоперазон – антибиотик широкого спектра действия 3-го поколения. Этот препарат позиционируется для лечения большой группы инфекционно-воспалительных заболеваний, в том числе инфекций желчевыводящих путей, перитонита, сепсиса, инфекций кожи, костей и мягких тканей, обладает бактерицидным действием и спектром антимикробной активности, которая включает большинство клинически важных патогенных возбудителей, а именно грамположительных (St. aureus, St. epidermidis, Str. рneumoniae, Str. рyogenes и др.), грамотрицательных (Cytrobacter spp., Enterobacter spp., E. сoli, Klebsiella spp., Pr. vulgaris, P. аeruginosa, Salmonella spp. и др.), анаэробные микроорганизмы (Bacterioides fragilis, Clostridium spp., Peptostreptococcus spp., Peptococcus spp., Veillonella spp.) [7]. В микробиологической структуре ИАИ, развивающихся в послеоперационном периоде или во время пребывания больного в стационаре, особое значение приобретают нозокомиальные штаммы энтерококков, а также Enterobacter spp., Acinetobacter spp., P. aeruginosa. Эти микроорганизмы отличаются высокой резистентностью к антибиотикам.
Интраабдоминальные инфекции, как правило, имеют полимикробную этиологию с участием широкого спектра грамотрицательных и грамположительных анаэробных и аэробных микроорганизмов (табл. 1).
Таким образом, к настоящему времени разработано значительное количество схем комбинированной и монотерапии ИАИ.
! Накопленные клинические данные, полученные в зарубежных и отечественных исследованиях, свидетельствуют о том, что схемы монотерапии, основанные на современных антибиотиках, превосходят по клинической и бактериологической эффективности схемы комбинированной терапии. Показано, что меропенем превосходит комбинацию цефуроксима с гентамицином, имипенем – комбинацию ципрофлоксацина с метронидазолом, цефоперазон/сульбактам – комбинацию клиндамицина с гентамицином. Эффективность комбинации цефоперазон/сульбактам в терапии ИАИ подтверждена многочисленными международными исследованиями.
Было проведено ретроспективное исследование для определения эффективности и безопасности эмпирического применения монотерапии с использованием комбинированных препаратов цефоперазона с сульбактамом по сравнению с меропенемом и комбинации цефепима с метронидазолом. В исследование вошли 468 пациентов, которым был поставлен диагноз «интраабдоминальный абсцесс» либо «перитонит». В исследование включали пациентов с внутрибрюшной инфекцией, находящихся в состоянии средней степени тяжести (тяжесть состояния пациентов по шкале APACHE II – менее 15). Пациенты были смешаны и разделены на группы: в первой группе назначали по 500 мг меропенема каждые 8 ч или 500 мг имипенема/циластатина каждые 8 ч, во второй – 2 г цефепима каждые 12 ч плюс 500 мг метронидазола два раза в сутки. Пациенты третьей группы получали препарат цефоперазона/сульбактама по 1 г каждые 12 ч. В каждой исследуемой группе лечебный эффект был достигнут.
Исследование, проведенное на базе Санкт-Петербургского государственного университета, доказало большую экономическую целесообразность применения цефаллоспоринов 3-го поколения для эмпирической терапии ИАИ по сравнению с карбапенемами [3]. Стоимость курса лечения антибактериальным препаратом включает в себя стоимость введения препарата, терапию побочных эффектов и осложнений.
Цефоперазон хорошо проникает во все органы и ткани, в терапевтических концентрациях выявляется в течение 12 ч после введения в перитонеальной (асцитической) жидкости, накапливается в легких и мокроте, ткани печени, желчи и стенке желчного пузыря, в почках, моче, костях. Препарат вводится: при инфекциях легкой и средней степени тяжести – 1-2 г каждые 12 ч; при тяжелых инфекциях – 2-4 г каждые 8 ч или 3-6 г каждые 12 ч. Длительность лечения составляет от 7 до 14 сут, что согласуется с данными доказательной медицины об использовании других антимикробных средств в лечении хирургических инфекций. Каких-либо побочных действий, существенно отличающихся от других цефалоспоринов, не описано.
Проведено сравнительное клиническое исследование эффективности и переносимости цефоперазона и цефтриаксона у пациентов с гнойно-воспалительными заболеваниями и послеоперационными осложнениями различной локализации. Группу сравнения составили 25 пациентов обоих полов в возрасте от 22 до 60 лет с острой хирургической патологией, которым в послеоперационном периоде назначался цефтриаксон. Основная группа включала 25 пациентов обоих полов в возрасте от 34 до 62 лет с гнойно-воспалительными процессами брюшной полости и забрюшинного пространства. Цефтриаксон назначали по 2 г два раза в сутки; цефоперазон – по 2 г дважды в сутки при инфекциях средней степени тяжести и по 2 г трижды в сутки при тяжелых инфекциях. Также проводилась стандартная посиндромная терапия гнойно-септических заболеваний. Эффективность препарата оценивалась по данным клинических и биохимических исследований, по непосредственным (3-й и 10-й день лечения) результатам. Характер динамических изменений биохимических показателей крови менялся в процессе проводимого комплексного лечения и статистической обработке не подвергался.
Результаты исследования свидетельствуют о 92% стартовой эффективности лечения цефоперазоном у пациентов с гнойно-воспалительными заболеваниями брюшной полости и забрюшинного пространства. У двух пациентов отмечалась резистентность к проводимой терапии, что было выявлено к концу 3-го дня лечения и потребовало замены антибактериального препарата. При использовании препарата в комбинации цефоперазон/сульбактам побочных действий, ограничивающих его применение, у исследуемых пациентов выявлено не было. Проведенная сравнительная оценка эффективности показывает его явное преимущество перед цефтриаксоном (80% стартовой эффективности).
Масштабное рандомизированное исследование продемонстрировало, что комбинация цефоперазон/сульбактам (91,9%) более эффективна в отношении снижения симптоматики и клинических признаков ИАИ, чем комбинация цефтазидим/амикацин/метронидазол (81,8%). Оценка результатов проводилась через 30 дней после окончания курса лечения [10]. Микробиологическая эффективность комбинации цефоперазон/сульбактам в отношении 202 выделенных патогенов, где наиболее частыми возбудителями были Escherichia coli (38,6%), Klebsiella spp. (12,9%), также была выше, а безопасность – значительно выше, чем в контрольной группе (частота побочных явлений составила 6,5% по сравнению с 16,4% в группе комбинации цефтазидим/амикацин/метронидазол). Частота прекращения участниками лечения ввиду побочных явлений составила 3,2% по сравнению с 9,9% в контрольной группе. Авторы сделали вывод, что комбинация цефоперазон/сульбактам может быть рекомендована как эффективное дополнение к хирургическому лечению ИАИ [10, 11].
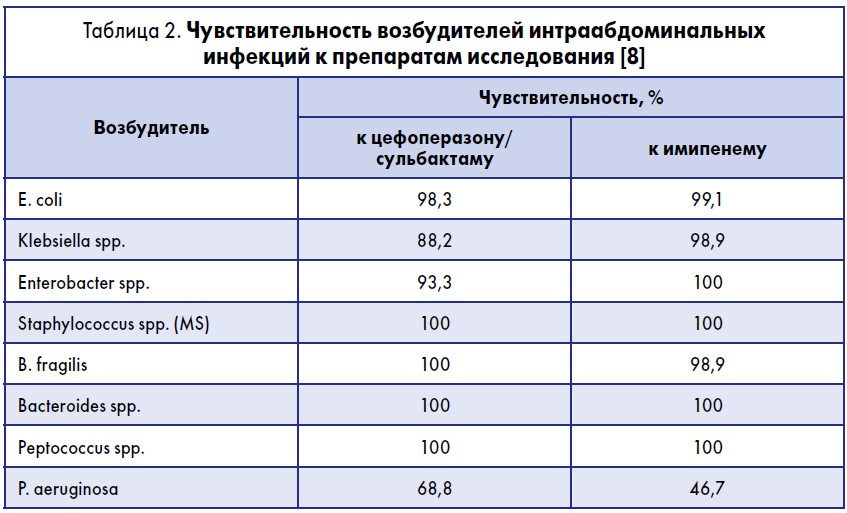
Программа эмпирической антибактериальной терапии инфекций в конкретном медицинском учреждении должна разрабатываться и корректироваться на основании локальных данных о возбудителях и их чувствительности к антибиотикам. Так, в РФ с этой целью было проведено многоцентровое исследование распространенности антибиотикорезистентности среди возбудителей внебольничных и госпитальных инфекций [6, 8]. Результаты исследования свидетельствуют о высокой чувствительности большинства патогенов к цефоперазону/сульбактаму (табл. 2).
Необходимо проведение контролируемых исследований в Украине по данной проблеме с целью выяснения клинико-микробиологической ситуации, сложившейся в нашей стране, а также уровня резистентности и частоты выделения возбудителей, которые значительно отличаются от зарубежных.
Таким образом, защищенные цефалоспорины 3-го поколения (Цефопектам, Цефтрактам) обладают широким спектром антимикробной активности в отношении большинства патогенов, повышают фармакоэкономическую эффективность лечения, снижают устойчивость микрофлоры и летальность в послеоперационном периоде. Это позволяет рекомендовать их для внедрения в практику здравоохранения при деэскалационной терапии (стартовом эмпирическом назначении антибиотика максимально широкого спектра) ввиду высокой клинической эффективности и экономической целесообразности.
Литература
1. Информационный бюллетень ВОЗ «Рассмотрение антибактериальных лекарственных средств в рамках пересмотра Примерного перечня ВОЗ основных лекарственных средств для взрослых и Примерного перечня ВОЗ основных лекарственных средств для детей в издании 2017 года». http://apps.who.int/iris/bitstream/10665/259481/1/9789241210157-eng.pdf?ua=1.
2. Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. – М.: Ремедиум, 2001.
3. Проблемы антибактериальной терапии осложненных интраабдоминальных инфекций в многопрофильном стационаре / Ю.М. Гомон, А.С. Колбин, Ю.Е. Балыкина, журнал «Ученые записки Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова», Т. 24, № 4 (2017).
4. Sartelli M. A focus on intra-abdominal infections. World Journal of Emergency Surgery 2010; 5.
5. Crowder V.H., Cohn I. Perforation in cancer of the colon and rectum. Dis Colon Rectum 1967; 10: 415-20.
6. Slower M.J., Hardcastle J.D. The results of 1115 patients with colorectal cancer treated over an 8-year period in a single hospital. Eur J Surg Oncol; 11: 119-23.
7. Бекетов А.С., Сидоренко С.В., Писарев В.В., Комаров P.M. Клинико-экономическая оценка антибактериальной терапии интраабдоминальных инфекций // Качественная клиническая практика. – № 3, 2002. Государственный научный центр по антибиотикам, Альянс клинических микробиологов и химиотерапевтов, г. Москва.
8. Grudinina S., Sidorenko S. et al. // lnternational Journal of antimicrobial Agents 7 (1996) 109-117.
9. Paul М., Leibovici L.L., Grozinsky S.G., Silbiger!.S., Soares-Weiser K. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for treating sepsis (Protocol for a Cochrane Review). In: The Cochrane Library, Issue 1, 2002. Oxford: Update Software.
10. Chandra A., Dhar P., Dharap S., Goel A., Gupta R., Hardikar J.V., Kapoor V.K., Mathur A.K., Modi P., Narwaria M., Ramesh M.K., Ramesh H., Sastry R.A., Shah S., Virk S., Sudheer O.V., Sreevathsa M.R., Varshney S., Kochhar P., Somasundaram S., Desai C., Schou M. Cefoperazone-sulbactam for treatment of intra-abdominal infections: results from a randomized, parallel group study in India. Surg Infect (Larchmt). 2008 Jun;9(3):367-76. doi: 10.1089/sur.2007.013.
Подготовила Ирина ДУКА
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 1 (35), лютий 2019 р.
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...