Мио-инозитол: терапевтические возможности и прегравидарная подготовка при синдроме поликистозных яичников
Обзор литературы
 Синдром поликистозных яичников (СПКЯ) как одна из наиболее частых причин овариальной дисфункции у женщин репродуктивного возраста стал достаточно часто встречающейся патологией в практике гинеколога-эндокринолога. Являясь причиной более половины случаев бесплодия эндокринного генеза (50-75%), СПКЯ повышает риск невынашивания беременности, а также таких перинатальных осложнений, как гестационный диабет (ГД), фетальная макросомия, гестационная гипертензия (преэклампсия, индуцированная беременностью гипертензия). Вследствие метаболических, гормональных нарушений пациентки с СПКЯ имеют повышенный риск ановуляторных циклов и составляют основную группу женщин, прибегающих к процедуре экстракорпорального оплодотворения (ЭКО) [1-7].
Синдром поликистозных яичников (СПКЯ) как одна из наиболее частых причин овариальной дисфункции у женщин репродуктивного возраста стал достаточно часто встречающейся патологией в практике гинеколога-эндокринолога. Являясь причиной более половины случаев бесплодия эндокринного генеза (50-75%), СПКЯ повышает риск невынашивания беременности, а также таких перинатальных осложнений, как гестационный диабет (ГД), фетальная макросомия, гестационная гипертензия (преэклампсия, индуцированная беременностью гипертензия). Вследствие метаболических, гормональных нарушений пациентки с СПКЯ имеют повышенный риск ановуляторных циклов и составляют основную группу женщин, прибегающих к процедуре экстракорпорального оплодотворения (ЭКО) [1-7].
Актуальность проблемы СПКЯ также обусловлена развитием мультисистемного синдрома, сопровождающегося нарушением функционирования многих органов и систем организма. Так, у этих пациенток в 10 раз повышен риск возникновения сахарного диабета 2 типа, в 7 раз – сердечно-сосудистой, а также онкологической патологии (рак эндометрия и молочной железы), что влияет не только на качество, но и на продолжительность жизни женщины. П
ри этом распространенность метаболического синдрома у больных с СПКЯ в 2 раза выше, чем в популяции: около 22% женщин в возрасте до 20 лет и 53% женщин от 30 до 39 лет с СПКЯ имеют соответствие критериям метаболического синдрома [4].
Ключевую роль в патогенезе СПКЯ играют инсулинорезистентность (ИР) и гиперандрогения (ГА), при этом высокий уровень андрогенов способствует формированию абдоминального ожирения и ИР, которая, в свою очередь, приводит к компенсаторной гиперинсулинемии (ГИ), обусловливая образование андрогенов в яичниках и коре надпочечников.
Тяжелые нарушения чувствительности к инсулину в состоянии компенсаторной ГИ имеют место не только у пациенток с СПКЯ и ожирением, но и у стройных женщин, это свидетельствует о том, что развитие ИР не зависит от массы тела [2, 6].
В настоящее время продолжается поиск фармакологических субстанций для патогенетической терапии СПКЯ [3-5]. Современные подходы в лечении, в основном, направлены на коррекцию ИР (метформин, пиоглитазон), восстановление менструального цикла (МЦ; комбинированные оральные контрацептивы, прогестероносодержащие препараты) и овуляции (кломифена цитрат), уменьшение проявлений ГА (спиронолактон, флутофарм), представляя собой симптоматическую терапию.
Поэтому весьма активно продолжаются исследования фармацевтических средств, которые могут обеспечить наиболее эффективную и безопасную терапию СПКЯ с помощью оптимизации процессов саморегуляции. Именно на коррекцию метаболических нарушений направлены рекомендации по модификации образа жизни, которые предусматривают рациональное питание, дозированные физические нагрузки, а также дополнительный прием витаминно-минеральных комплексов, поскольку СПКЯ – это нейроэндокринный синдром, требующий постоянной сопроводительной терапии [4, 6].
На сегодняшний день перспективным направлением в профилактике и лечении симптомов СПКЯ, а также обусловленного синдромом бесплодия считается применение мио-инозитола (MI). При этом наиболее интересным направлением можно считать включение этого микронутриента в программу прегравидарной подготовки и поддержки беременности у таких пациенток.
 Открытие MI, выделенного из ростков пшеницы немецким ученым Ю. Либихом в 1848 г., позволило в 1902 г. внести этот микронутриент в классификацию витаминов как витамин В8. MI – основной стереоизомер инозитола (шестиатомного спирта циклогексана), существующий в девяти стереоизомерах, из которых в живой клетке присутствует только одна форма – мио-инозитол (рис. 1).
Открытие MI, выделенного из ростков пшеницы немецким ученым Ю. Либихом в 1848 г., позволило в 1902 г. внести этот микронутриент в классификацию витаминов как витамин В8. MI – основной стереоизомер инозитола (шестиатомного спирта циклогексана), существующий в девяти стереоизомерах, из которых в живой клетке присутствует только одна форма – мио-инозитол (рис. 1).
На сегодняшний день MI является жизненно необходимым микронутриентом, около 3/4 его суточной потребности синтезируется преимущественно из глюкозы в печени и почках, некоторая часть попадает с пищей [3]. Источником поступления MI в наш организм являются растительные продукты: зерновые, бобовые, орехи, дыни и апельсины.
При этом в растительных продуктах MI в основном содержится в виде фитиновой кислоты, что на 50% уменьшает его биодоступность. В организме человека MI в свободной форме синтезируется в почках, а также в половых железах и головном мозге (около 4 г/сут) [4].
Следует отметить, что основной функцией MI является участие во внутриклеточной передаче сигнала и обеспечении функционирования целого ряда рецепторов (к инсулину, половым гормонам, факторам роста и катехоламинам; рис. 2).
Инозитолозависимые белки необходимы для поддержания функционирования сердечно-сосудистой, иммунной (снижение аутоиммунных воспалительных реакций) и центральной нервной (когнитивные нарушения, депрессии, панические атаки) систем, участвуют в метаболизме глюкозы (в сигнальном каскаде инсулина). MI является синергистом витаминов (B5, PP), минералов (кальция, магния) и фолатов [3, 8].
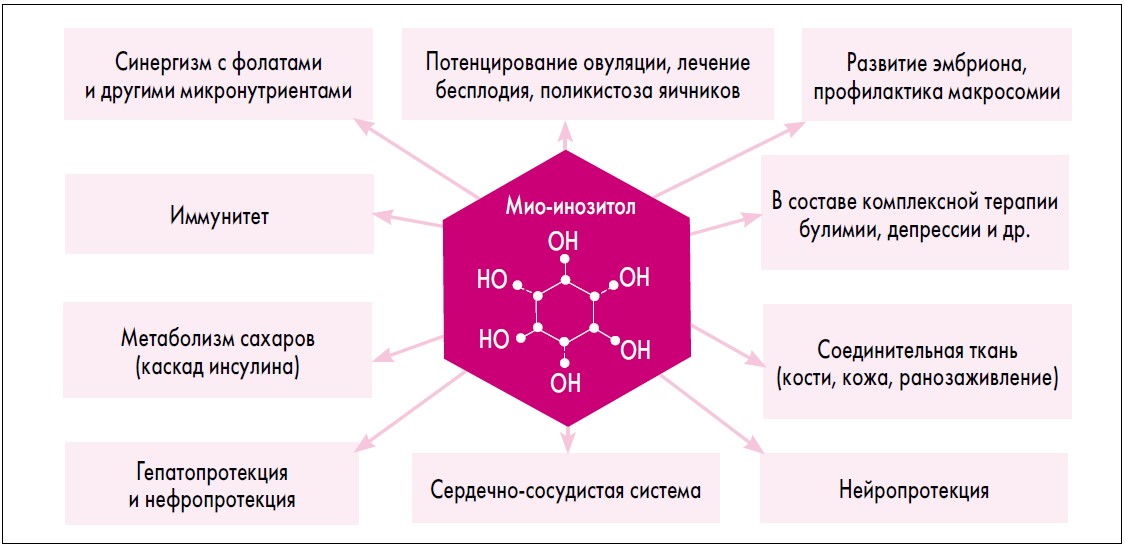 Рис. 2. Основные направления терапевтического применения и метаболические функции MI
Рис. 2. Основные направления терапевтического применения и метаболические функции MI
Оказалось, что в клеточных мембранах инозитол находится в виде фосфатидил-мио-инозитола и является предшественником инозитолтрифосфата, играя роль вторичного мессенджера, который регулирует деятельность таких гормонов, как инсулин и фолликулостимулирующий гормон (ФСГ), катехоламины. Было также доказано, что MI влияет на функционирование сперматозоидов, регулируя осмолярность и объем семенной плазмы, экспрессию белков, необходимых для эмбрионального развития, и подвижность сперматозоидов [9].
MI является компонентом клеточных мембран, играет важную роль в клеточном морфогенезе и цитогенезе, синтезе липидов, в поддержании структуры клеточных мембран и клеточном росте [4]. Именно MI выступает в качестве передатчика сигнала регуляции уровней внутриклеточного кальция, сигнала от рецептора инсулина, участвует в расщеплении жиров и снижении уровня холестерина в крови, модуляции активности нейротрансмиттеров (рис. 2) [8].
Изучение влияния производных MI на повышение фертильности выявило их взаимодействие со специфическими белками, участвующими в функционировании репродуктивной системы и развитии эмбриона. Было установлено, что повышение концентрации MI в фолликулярной жидкости в предовуляторный и овуляторный период необходимо для полноценного созревания фолликулов и является маркером хорошего качества ооцитов [9].
Оказалось также, что инозитолозависимые сигналы имеют важное значение на заключительных стадиях созревания яйцеклетки при подготовке к успешной активации клетки в момент оплодотворения [10].
Специфические воздействия MI на репродуктивную функцию связаны с участием его производных в сигнальных каскадах белковых рецепторов гонадолиберина (гонадотропин-рилизинг-гормона), ФСГ и лютеинизирующего гормона (ЛГ). MI воздействует, в частности, на инвазию трофобласта при закреплении бластоцисты, функции яичников, ооцитов и плаценты. Помимо этих прямых специфических эффектов, MI также поддерживает функционирование репродуктивной системы опосредованно [3, 10].
Целью нашего исследования стал анализ мирового опыта применения MI для лечения овариальной дисфункции и прегравидарной подготовки пациенток с СПКЯ.
Анализ данных литературы
Cистематический анализ более чем 37 тыс. публикаций, посвященных MI и его производным, продемонстрировал его важность для поддержания физиологического течения многих процессов в организме человека [7].
В зону нашего внимания попала достаточно большая часть исследований, посвященных изучению влияния MI на метаболические нарушения, в частности ИР, у пациенток с СПКЯ.
Систематический анализ эффектов MI у пациенток с СПКЯ показал, что его пероральный прием в дозе 4 г/сут способствует преодолению ИР, нормализации липидного профиля, артериального давления, снижению избыточной секреции андрогенов (в частности лечению гирсутизма, акне, андрогенозависимой алопеции) [3].
Действие MI при СПКЯ может быть связано с повышением чувствительности к инсулину и последующим увеличением поглощения внутриклеточной глюкозы [11].
Дальнейшее изучение метаболических эффектов MI показало, что он улучшает липидный профиль у женщин с СПКЯ. Согласно оценке липидного профиля у пациенток с ожирением (индекс массы тела – ИМТ – 34±6 кг/м2) до и после 6 месяцев терапии выявлено статистически достоверное повышение уровня липопротеинов высокой плотности, снижение уровней липопротеинов низкой плотности и триглицеридов на фоне снижения ИР [12].
Еще в одном исследовании прием MI в течение 8 недель в группе пациенток с ожирением и СПКЯ (n=42) позволил снизить ИМТ и уровень инсулина наряду со снижением концентрации ЛГ и соотношения ЛГ/ФСГ [13].
Как известно, для лечения овуляторной дисфункции у пациенток с СПКЯ успешно применяются метформин и пиоглитазон. Однако их прием достаточно часто ограничивается возникновением таких побочных эффектов, как тошнота, диарея (при использовании метформина) и увеличение массы тела (при приеме пиоглитазона), что обусловливает низкий комплайенс и отказ от продолжения терапии [14].
Результаты сравнительного исследования [15] лечения пациенток с СПКЯ и ановуляцией показали, что у 50% пациенток, получавших метформин, восстановилась спонтанная овуляция, у 18% наступила беременность. В группе получавших MI спонтанная овуляция восстановилась у 65% пациенток, а у 30% пациенток наступила беременность. В группе получавших MI отсутствовали какие-либо побочные эффекты терапии, что повысило приверженность к ней.
Согласно результатам исследования итальянских ученых [16], курсовый прием MI позволил предупредить развитие ГД у 83 беременных с СПКЯ. В группе пациенток, принимавших MI в течение всей беременности (n=46), ГД развился только у 17%, а в группе контроля – у 54%. Таким образом, риск развития ГД без поддерживающего лечения MI повышался более чем в 2 раза.
Полученные данные повышают клинический интерес к MI как потенциальному сенсибилизатору инсулина, который может быть использован в качестве безопасного и эффективного варианта лечения пациенток с СПКЯ путем восстановления их метаболического профиля и последующей индукции овуляции у больных с бесплодием. Кроме того, результаты исследований демонстрируют высокий уровень безопасности молекулы MI даже при ее введении до 12 г/день, что вызывает лишь незначительные побочные эффекты со стороны желудочно-кишечного тракта [17, 18, 31].
Кроме этого, как показали результаты применения MI у пациенток с СПКЯ с нормальной массой тела, в результате терапии наблюдалось повышение антиоксидантного ресурса (глутатион в цитозоле), снижались ИР, уровни андростендиона и тестостерона в сыворотке крови, пролактина и инсулина, нормализовались уровни ЛГ, повышалась чувствительность клеток к инсулину, нормализовалась кривая уровня сахара [19].
MI также может использоваться для устранения андрогенных нарушений при СПКЯ. В частности, при назначении MI в дозе 4 г/сут 50 пациенткам с СПКЯ в течение 6 месяцев уже через 3 месяца терапии уровни ЛГ, тестостерона, свободного тестостерона, инсулина в плазме крови существенно снизились.
Гирсутизм и акне достоверно уменьшились после 6 месяцев терапии [17]. Прием MI в дозе 4 г/сут на протяжении 12-16 недель в двойном слепом плацебо-контролируемом исследовании с участием 42 пациенток с СПКЯ способствовал достоверному снижению уровней тестостерона, триглицеридов, инсулина, нормализации артериального давления и восстановлению овуляции [18, 20, 21].
Однако наибольший интерес представляют исследования влияния MI на повышение фертильности в качестве прегравидарной подготовки и ведения женщин перед циклом ЭКО.
В ряде научных работ доказано, что дефицит MI у женщин с СПКЯ связан с плохим качеством ооцитов и нарушением фолликулогенеза [15]. Согласно результатам некоторых исследований, высокие концентрации MI в фолликулярной жидкости ассоциировались с хорошим качеством ооцитов, что способствовало развитию высококачественных эмбрионов у субфертильных пациенток.
Были обнаружены положительные и значимые корреляции между концентрациями MI и сегментацией оплодотворенных яйцеклеток. Кроме того, введение MI женщинам, которые проходили циклы ЭКО, давало возможность уменьшать дозу рекомбинантного ФСГ и продолжительность его введения.
При этом улучшалось качество ооцитов и эмбрионов, а также скорость имплантации [22]. Следовательно, повышение концентрации MI в фолликулярной жидкости в периовуляторный и овуляторный период необходимо для полноценного созревания фолликулов и является маркером хорошего качества ооцитов [23].
Таким образом, включение MI в программу подготовки к ЭКО способствует улучшению результатов вспомогательных репродуктивных технологий. Кроме того, согласно данным проспективных рандомизированных контролируемых исследований, MI улучшает качество не только женских, но и мужских гамет [24-27].
Вследствие того, что MI является синергистом фолиевой кислоты (ФК), комбинация этих микронутриентов является наиболее перспективной в лечении женщин с СПКЯ и ановуляцией. Как известно, фолаты необходимы для метилирования ДНК – процесса, без которого невозможно клеточное деление. MI, воздействуя на процессы метилирования ДНК посредством инозитолозависимых белков (аденозилгомоцистеин‑2, Са/интегрин-связывающий белок 1, метил-CpG-связывающий белок 2), является природным синергистом фолатов, ионов железа, витамина РР и пантотеновой кислоты [10].
В рандомизированном двойном слепом плацебо-контролируемом исследовании эффектов MI показано достоверное улучшение функций яичников у женщин с СПКЯ. Пациентки контрольной группы (n=47) получали 400 мкг ФК, а пациентки основной группы (n=45) – MI в дозе 4 г/сут и ФК 400 мкг/сут.
Уровень эстрадиола был достоверно выше у пациенток основной группы уже с первой недели лечения. Прием MI способствовал увеличению уровня липопротеинов высокой плотности. В основной группе количество пациенток, у которых восстановилась овуляция, было больше по сравнению с таковым в группе плацебо (25 и 15% соответственно), а время наступления первой овуляции существенно короче (25 суток, в группе плацебо – 41 сутки; р <0,05) [20].
В другом исследовании [21] подтверждена эффективность MI в восстановлении МЦ. В группе из 70 женщин в возрасте 18-35 лет 35 пациенток с ановуляторным циклом получали ФК 200 мкг/сут и MI 2 г/сут в течение 24 недель, а остальные 35 пациенток – плацебо. После 24 недель лечения только 5 пациенток, принимавших MI, имели ановуляторный цикл (в контрольной группе – 14 пациенток), что соответствовало 4-кратному снижению риска ановуляторного цикла (р=0,016).
В крупном обсервационном исследовании [8] участвовали 3602 женщины с бесплодием, которые в течение 2-3 месяцев применяли 4000 мг MI + 400 мкг ФК в день. На протяжении этого времени у 70% женщин восстановилась овуляция и были зафиксированы 545 случаев беременности.
Это означает, что частота наступления беременности у пациенток, принимающих MI и ФК, составила 15,1%. Уровень тестостерона и прогестерона изменился соответственно с 96,6 до 43,3 нг/мл и с 2,1 до 12,3 нг/мл (р <0,05) после 12 недель лечения. Побочные эффекты отсутствовали.
Еще в одном исследовании было выявлено, что у пациенток, принимавших MI + ФК, овуляция восстановилась в 82% случаев, тогда как у пациенток группы плацебо – всего в 63%. В то же время у 70% женщин, принимавших MI, после 16 недель лечения МЦ стал регулярным, а в группе плацебо – всего лишь у 13% [19]. Проведенный позже метаанализ [24] подтверждает эти показатели.
При дозировке MI 4000 мг и ФК 400 мг не наблюдалось никаких побочных эффектов, в особенности тех, которые обычно возникают при использовании в высоких дозах (1500 мг/сут) других сенсибилизаторов инсулина, в частности метформина.
Таким образом, результаты ряда исследований подтвердили, что у большинства бесплодных пациенток с СПКЯ прием MI восстанавливает спонтанную овуляцию, регулярность МЦ и увеличивает секрецию прогестерона. Воздействие MI на ИР, избыточную массу тела, ГА, гирсутизм, акне, олиго- и аменорею, повышенный уровень ЛГ, а также антиоксидантное действие позволили включить его в комплексные программы подготовки к ЭКО в странах Европы, США, Японии, Южной Корее и др. [3].
Следует отметить, что наиболее контраверсионным остается вопрос выбора типа инозитола для лечения ановуляции и подготовки к беременности у женщин с СПКЯ.
Мио-инозитол или D-хиро-инозитол?
В организме человека более 95% инозитолов находятся в форме MI, который является депо инозитолов. Из MI происходит синтез упоминаемых ранее инозитоловых производных, участвующих в сигнальных каскадах, в частности D-хиро-инозитола (DCI, аналог оптического изомера инозитола). Последний синтезируется из MI посредством специального фермента эпимеразы и участвует в передаче внутриклеточного сигнала от рецептора инсулина [28, 29].
В клетках, отвечающих за депонирование гликогена (печень, мышцы, жировая ткань), отмечается высокое содержание DCI, в то время как в клетках мозга и сердца преобладает MI, поскольку они требуют значительно более быстрого усвоения глюкозы. Соотношение MI/DCI является тканеспецифическим.
В яичниках (фолликулярной жидкости) здоровых женщин оно составляет 100:1, в то время как у пациенток с СПКЯ – 0,2:1. При этом в репродуктивных органах, таких как яичник, MI регулирует поглощение глюкозы и участвует в сигнализации ФСГ, в то время как DCI отводится участие в процессе инсулин-опосредованного синтеза андрогенов [30-33].
Применение DCI в высокой дозе при использовании вспомогательных репродуктивных технологий обусловило его негативное влияние на качество ооцитов и ответ яичников на введение ФСГ [3]. Так, данные, опубликованные Isabella и Raffone, свидетельствуют о том, что повышение дозы DCI приводит к «интоксикации яичников», проявляющейся негативным влиянием на качество ооцитов и снижением ответа яичников на ФСГ [34].
Этот феномен, возможно, объясняют результаты исследования по изучению влияния MI и DCI на качество ооцитов у пациенток с СПКЯ. Так, было установлено, что общее количество ооцитов в двух группах не различалось, тогда как количество зрелых ооцитов, эмбрионов хорошего качества и беременностей было существенно выше в группе пациенток, получавших MI [32]. Было сделано предположение о том, что у пациенток c СПКЯ и ИР активность эпимеразы в яичниках повышена, соответственно происходит усиленная конверсия MI в DCI с последующим дефицитом MI [35].
Уменьшение соотношения MI и DCI, в свою очередь, может способствовать снижению качества ооцитов у пациенток с СПКЯ [36]. Более того, предполагаемый дефицит MI в яичниках может способствовать нарушению действия ФСГ и повышенному риску развития синдрома гиперстимуляции яичников [32]. Известно, что пациентки, имеющие высокие уровни инсулина, нуждаются в большем количестве ФСГ для стимуляции яичников [35].
Имеются данные о том, что восполнение уровня MI (предпочтительно за 3 месяца до стимуляции яичников) дает возможность снизить дозу назначаемого рекомбинантного ФСГ при проведении программ ЭКО и способствует повышению вероятности наступления беременности у пациенток с СПКЯ [3]. Поэтому для проведения прегравидарной подготовки у таких пациенток следует отдавать предпочтение именно препаратам MI.
Среди MI-содержащих препаратов наибольший интерес, на наш взгляд, представляет комплексный препарат Миофолик производства британской компании Amaxa Pharma. В его состав входит MI (2000 мг), ФК 4-го поколения (200 мкг) и витамин В12 (5 мкг). Среди преимуществ этого препарата необходимо отметить оптимальную дозировку MI, эффективность которой доказана в клинических исследованиях (при рекомендованном приеме 2 пакетиков в день пациентка получает 4000 мг (4 г) МІ в сутки).
Кроме того, Миофолик от Amaxa Pharma – единственный препарат в Украине, содержащий терапевтически эффективную дозу MI и ФК в ее активной форме – 5-метилтетрагидрофолата. Эта форма отличается 100% биодоступностью независимо от наличия мутации гена MTHRR (полиморфизм C677T), из-за которой усвоение фолатов из пищи невозможно. Данная активная форма чрезвычайно важна именно для пациенток с СПКЯ, у которых указанный генный полиморфизм наблюдается в 4 раза чаще, чем в целом в популяции (30-40% населения имеют мутацию гена MTHRR) [6].
Витамин В12 в составе препарата улучшает усвоение ФК и действует в синергизме с ней, а также предотвращает риск развития дефицита витамина В12 и обладает нейропротективным воздействием, способствуя повышению концентрации внимания и памяти, снижению раздражительности. Витамин В12 активно применяется для профилактики невынашивания беременности и дефектов нервной трубки плода.
Следует также отметить удобство применения водорастворимой формы препарата Миофолик, особенно важное для беременных, что повышает комплайентность, а значит – и эффективность лечения.
Благодаря положительному влиянию на репродуктивную функцию данного комплекса витаминов, можно рекомендовать продолжать его прием и после наступления беременности с целью снижения риска выкидыша на ранних сроках, развития ГД и преэклампсии (в отличие от препаратов DCI, прием которых при наступлении беременности следует сразу же прекратить) [36-41].
Выводы
Анализ полученных результатов исследований, посвященных применению MI в комплексной терапии пациенток с СПКЯ, свидетельствует о благотворном влиянии этой молекулы: уменьшаются метаболические нарушения, ГА, гирсутизм, акне, частота олиго- и аменореи, а также происходит восстановление овуляторных циклов.
В качестве MI-содержащего препарата для проведения прегравидарной подготовки у женщин с СПКЯ можно рекомендовать Миофолик (Amaxa Pharma) как инновационный комплекс с активной формой ФК и терапевтически эффективной дозой MI для профилактики пороков развития нервной трубки плода, предупреждения гипергомоцистеинемии, ГД и невынашивания беременности.
Список литературы находится в редакции.
Статья печатается в сокращении.
Репродуктивна ендокринологія,
№ 4 (42), 2018 р.
Тематичний номер «Акушерство, Гінекологія, Репродуктологія» № 3 (31), жовтень 2018 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...
Хронічний тазовий біль (ХТБ) є поширеним патологічним станом, який відзначається у жінок будь-якого віку і супроводжується сексуальною дисфункцією, емоційною лабільністю, аномальними матковими кровотечами, порушенням сечовипускання, розладами з боку кишечника тощо. Пацієнтки, які страждають на ХТБ, часто скаржаться на симптоми тривоги та депресії, що негативно позначається на їхній повсякденній активності, включаючи зниження працездатності та погіршення якості життя [1]. Сьогодні проблема ХТБ є економічним тягарем, пов’язаним із прямими або непрямими медичними витратами, які в середньому в різних країнах світу оцінюються у 4,9 млрд доларів на рік [2]. Раціональна фармакотерапія,спрямована на полегшення та контроль симптомів болю, є ключовою стратегією боротьби із ХТБ...
Дефіцит заліза є найпоширенішим патологічним станом у світі та однією з п’яти основних причин інвалідності. У той час як низький показник феритину у сироватці крові є діагностичною ознакою залізодефіциту, підвищений його рівень визначається як гострофазовий маркер, що може реєструватися при запальних станах уже в І триместрі вагітності. Відповідно до сучасних настанов, проведення рутинного скринінгу на залізодефіцит у невагітних та вагітних жінок за відсутності ознак анемії не рекомендоване. З огляду на останні літературні дані ця рекомендація має бути переглянута...
Наказ Міністерства охорони здоров’я України від 25.08.2023 № 1533 ...




