Побічні ефекти імунотерапії
Відповіді на найпоширеніші запитання
Експертна група Європейського товариства медичної онкології (European Society for Medical Oncology, ESMO) у 2017 р. розробила посібник, призначений допомогти онкологічним пацієнтам і їх родинам зрозуміти природу побічних ефектів імунотерапії, а також побудувати оптимальну стратегію з мінімізації токсичності сучасних методів імунотерапії (зокрема, інгібіторів контрольних точок – ІКТ). За основу документа взяті клінічні настанови ESMO щодо ведення пацієнтів з проявами токсичності внаслідок імунотерапії, які базуються на доказах, отриманих у результаті недавніх клінічних досліджень, і висновках провідних експертів.
Створення ESMO посібника для пацієнтів є важливим інструментом для налагодження діалогу між лікарем, пацієнтом і його родичами, підвищення рівня довіри між суб’єктами лікувального процесу. Пильність пацієнта дає можливість своєчасно виявити побічні явища, пов’язані з імунотерапією, та провести їх ефективну корекцію.
? Яка роль імунної системи при онкологічній патології?
Функція імунної системи полягає у захисті людського організму від чужорідних агентів, у тому числі патогенних мікроорганізмів та ракових клітин. За нормальних умов імунна відповідь включає такі послідовні механізми: розпізнавання потенційно шкідливих агентів, активація клітинного та гуморального імунітету, атака проти аномальної клітини, припинення атаки після нейтралізації чужорідного агента. Крім фізичних і хімічних імунних бар’єрів, захист організму здійснюється за допомогою різних типів лейкоцитів (нейтрофілів, базофілів, еозинофілів, моноцитів, Т-клітин, В-клітин, природних кілерів і макрофагів). Слід також відрізняти вроджену імунну відповідь, яка є швидкою, але неспецифічною, та набуту, яка є значно повільнішою, проте специфічною та більш дієвою проти конкретного чужорідного агента. Саме набута імунна відповідь є точкою ефективного терапевтичного впливу при лікуванні деяких форм раку.
Розвитку більшості ракових пухлин запобігає знищення аномальних клітин імунною системою. Проте ракові клітини виробили кілька шляхів уникнення цього руйнівного впливу: приховування своєї ідентичності (через зниження експресії поверхневих пухлинних антигенів, що ускладнює механізм розпізнавання аномальних клітин), створення бар’єра (експресія поверхневих протеїнів, які здатні інактивувати імунні клітини), вплив на інші клітини (призводить до вивільнення речовин, що пригнічують імунні клітини та сприяють проліферації ракових клітин).
? Як імунотерапевтичні засоби впливають на імунну систему та ракові клітини?
Механізм дії імунних онкологічних препаратів полягає у підвищенні здатності природної протиракової імунної відповіді знищувати ракові клітини (Kamta et al., 2017). Виділяють пасивну й активну імунотерапію. Пасивна імунотерапія сприяє підвищенню власної імунної відповіді організму (наприклад, ІКТ), активна – спрямовує імунні клітини на розпізнавання, атакування та пригнічення ракових клітин (наприклад, протиракові вакцини). Сьогодні більш успішним напрямом є пасивна імунотерапія, зокрема застосування ІКТ.
Імунні контрольні точки забезпечують природний захист організму від аутоімунних механізмів для запобігання пошкодженню здорових клітин. Однак контрольні точки можуть перешкоджати розпізнаванню, атакуванню та руйнуванню ракових клітин.
У сучасній клінічній практиці застосовують два типи ІКТ: інгібітори білка 4, асоційованого з цитотоксичними
Сьогодні для використання у клінічній практиці затверджено препарати іпілімумаб (інгібітор CTLA‑4), ніволумаб, пембролізумаб (інгібітори PD‑1), атезолізумаб, авелумаб, дурвалумаб (інгібітори PD-L1) та комбінацію іпілімумаб + ніволумаб.
? Які відмінності між імунотерапевтичними лікарськими засобами, хіміотерапевтичними та таргетними препаратами?
Усі напрями лікування раку (імунотерапія, хіміотерапія, таргетна терапія) зумовлюють побічні ефекти, проте вони є різними і потребують диференційованого підходу.
Хіміотерапія спрямована на пряме знищення ракових клітин чи пригнічення їх поділу. Хіміопрепарати призначені для впливу лише на ракові клітини, які діляться та розмножуються швидше, ніж здорові клітини організму, проте ця селективність є недосконалою. Наприклад, клітини кісткового мозку, слизового епітелію кишечнику та волосяних фолікулів також характеризуються швидким відновленням, що пояснює природу частих побічних ефектів хіміотерапії: панцитопенії, гастроінтестинальних розладів (нудоти, блювання, діареї), випадання волосся. Після закінчення курсу хіміотерапії та відновлення нормальних клітин побічні ефекти зникають.
Таргетна терапія використовується для лікування деяких типів раку у відібраної за молекулярними характеристиками пухлин групи пацієнтів. Як і інші види лікування раку, таргетна терапія супроводжується розвитком побічних ефектів, що залежать від мішені препарату. Найчастішими побічними ефектами є діарея, ураження печінки, шкіри, серцево-судинної системи. Враховуючи те, що більшість таргетних препаратів впроваджені порівняно недавно, не вистачає даних щодо віддалених побічних наслідків такого лікування.
На відміну від хіміо- та таргетних препаратів, імунотерапевтичні засоби діють опосередковано. Побічні ефекти імунотерапії зумовлені різними формами імунних реакцій. ІКТ можуть провокувати різні імунно-опосередковані реакції у вигляді аутоімунних проявів.
? Які побічні ефекти імунотерапії можливі?
Здебільшого побічні ефекти лікування ІКТ є легкими та зворотними, якщо пацієнт своєчасно звернувся за медичною допомогою.
Імунно-опосередковані побічні ефекти (ІПЕ) можуть розвиватися з боку будь-якого органа, найчастіше шкіри, товстої кишки, легенів, печінки та ендокринних залоз (Haanen et al., 2017). При виникненні будь-яких симптомів слід негайно звернутися до свого онколога, який зможе забезпечити ретельний моніторинг стану хворого та контроль за побічними ефектами. ІПЕ можуть виникнути як під час лікування, так і після його закінчення. Онколога слід повідомити про розвиток таких побічних явищ: підвищена втомлюваність, висип та свербіж шкіри, гастроінтестинальні розлади (сильний абдомінальний біль, діарея, особливо за наявності крові та слизу у випорожненнях), ознаки порушення функції ендокринних залоз (втома, втрата маси тіла, нудота, блювання, надмірна спрага, підвищений апетит), задишка, кашель, головний біль, біль чи слабкість у м’язах, оніміння кінцівок, болючість і набряк суглобів, лихоманка невідомого генезу, схильність до появи синців, погіршення зору.
Побічні ефекти на тлі прийому ІКТ зазвичай виникають досить рано (протягом перших 3 місяців лікування), проте перші прояви можливі навіть через кілька днів після початку терапії чи через 1 рік після її закінчення (Haanen et al., 2017). Вважається, що часовий діапазон ІПЕ відображає еволюцію імунної відповіді організму на рак, яка в результаті застосування ІКТ посилюється. Можлива надмірна активація імунної відповіді та розвиток аутоімунних процесів.
Загалом небажані явища з боку шкіри асоціюються з прийомом ІКТ обох типів, тоді як гастроінтестинальні прояви частіше виникають при використанні інгібіторів CTLA‑4, а симптоми ураження легенів і щитоподібної залози – інгібіторів PD‑1 (Haanen et al., 2017). Гепатотоксичність зустрічається рідше, її частота приблизно однакова при застосуванні ІКТ обох груп.
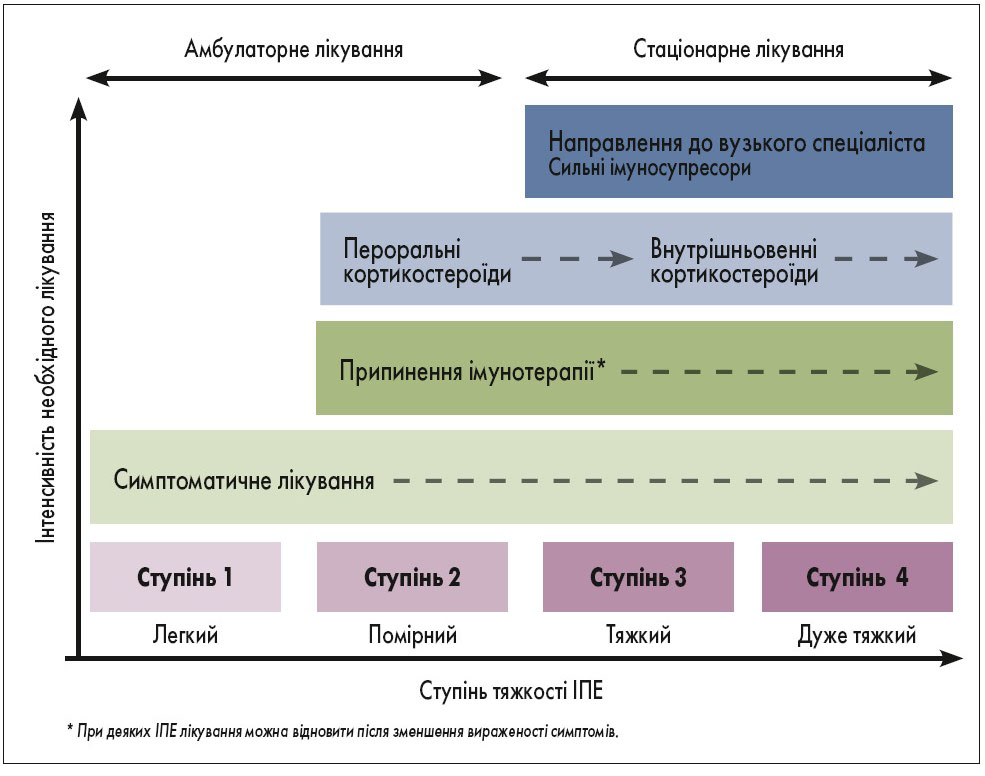
Побічні ефекти будь-якої терапії раку класифікують за тяжкістю симптомів на 4 ступені. Критерії оцінки для кожного побічного явища відрізняються. Наприклад, розглянемо ступені тяжкості найбільш поширеного побічного ефекту ІКТ – шкірного висипу:
- ступінь 1 – висип займає площу <10% поверхні тіла з симптомами або без них;
- ступінь 2 – висип займає площу <10‑30% поверхні тіла з симптомами, які впливають на звичний спосіб життя, або без них;
- ступінь 3 – висип займає площу >30% поверхні тіла з симптомами, які впливають на здатність до догляду за собою, або без них;
- ступінь 4 – висип займає площу >30% поверхні тіла з супутнім інфікуванням чи іншим ускладненням, що потребує негайної госпіталізації пацієнта.
? Які розроблено методи корекції побічних ефектів імунотерапії?
При появі побічних ефектів ступенів 1 та 2 проводять симптоматичне лікування без припинення чи переривання основної терапії. При наявності стійких симптомів ступеня 2 пацієнту можуть рекомендувати пропустити прийом однієї чи кількох доз імунопрепарату, а також проводять симптоматичне лікування. Розвиток побічних ефектів ступенів 3 та 4 є підставою для припинення імунотерапії та направлення хворого до вузького спеціаліста (наприклад, при ураженні шкіри – до дерматолога; рис.).
Рис. Принципи лікування побічних ІПЕ
Важливо наголосити на тому, що побічні ефекти, які потребують припинення основного лікування, виникають відносно рідко. Ранні дані свідчать, що застосування системних кортикостероїдів чи сильніших імуносупресорів не вплине та те, як пухлина реагуватиме на введення ІКТ. Так само відміна ІКТ не призведе до погіршення відповіді на лікування (Champiat et al., 2016).
За матеріалами: Immunotherapy-related side effects. ESMO Patients Guide, 2017.
Переклала з англ. Ілона Цюпа
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (62), 2020 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...