Терапія серцево-судинних патологій та пов’язаних із ними ризиків у хворих на цукровий діабет
Серцево-судинні захворювання атеросклеротичного ґенезу (АССЗ) є основними причинами захворюваності та смертності через ССЗ в осіб із цукровим діабетом (ЦД). Коморбідні артеріальна гіпертензія (АГ) та дисліпідемія у пацієнтів із ЦД 2-го типу – очевидні фактори ризику розвитку АССЗ. Американська діабетична асоціація (ADA) на основі сучасних доказових даних розробила стандарти надання медичної допомоги особам із ЦД, що включають, зокрема, практичні рекомендації з діагностики та лікування ССЗ і пов’язаних із ними ризиків у хворих на ЦД. Пропонуємо до вашої уваги огляд основних положень настанови, опублікованої у виданні Diabetes Care (2020; 43 (1): S111-S134).
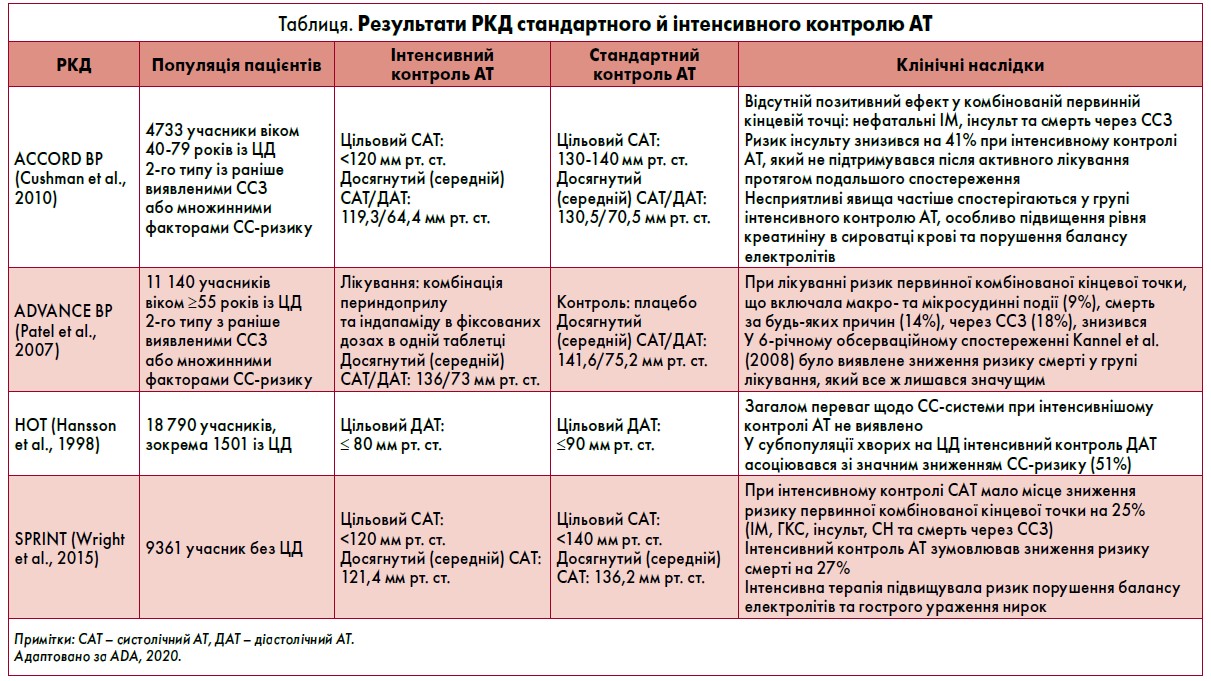
У багатьох дослідженнях було доведено ефективність контролю окремих факторів серцево-судинного (СС) ризику для запобігання або уповільнення розвитку АССЗ у пацієнтів із ЦД. Результати потужної модифікації факторів ризику в осіб із ЦД засвідчили, що показники 10-річного ризику ішемічної хвороби серця (ІХС) серед дорослих американців із ЦД за останнє десятиліття значно знизилися, як і захворюваність на ІХС та смертність (Ali et al., 2013; Buse et al., 2007; Gaede et al., 2008).
Серцева недостатність (СН) – ще одна основна причина захворюваності та летальності через ССЗ. Нещодавні дослідження виявили, що частота госпіталізації з приводу СН (з огляду на вік і стать) була вдвічі вищою у пацієнтів із ЦД, ніж без нього (Cavender et al., 2015; McAllister et al., 2018). Також було показано, що при застосуванні інгібіторів натрій-глюкозного котранспортера 2-го типу (SGLT2) в осіб із ЦД 2-го типу, більшість з яких мали АССЗ, вдалося досягти зниження частоти госпіталізації через СН (Zinman et al., 2015; Neal et al., 2018).
Фактори СС-ризику в осіб із ЦД
Для профілактики та лікування як АССЗ, так і СН слід систематично оцінювати фактори СС-ризику принаймні щорічно у всіх хворих на ЦД. До них відносять ожиріння / зайву вагу, АГ, дисліпідемію, куріння, сімейний анамнез ранньої ІХС, хронічну хворобу нирок та альбумінурію. Для оцінки 10-річного ризику розвитку ССЗ використовують шкалу Американської колегії кардіологів / Американської асоціації серця (ACC/AHA). Аналізують такі показники, як стать, раса, рівень загального холестерину, ліпопротеїнів високої щільності, артеріального тиску (АТ), наявність призначеної антигіпертензивної терапії, ЦД, шкідливих звичок (куріння).
Пацієнти з АГ та ЦД
АГ, яка визначається як стійкий АТ ≥140/90 мм рт. ст., часто зустрічається серед пацієнтів із ЦД. АГ є основним фактором ризику як АССЗ, так і мікросудинних ускладнень. За даними багатьох досліджень, антигіпертензивна терапія знижує частоту ССЗ, СН та мікросудинних подій (de Boer et al., 2017).
Скринінг та діагностика
АТ слід вимірювати при кожному візиті до лікаря. У пацієнтів із підвищеним АТ (≥140/90 мм рт. ст.) потрібно виконати низку вимірювань для підтвердження АГ (рівень доказовості B). Усі хворі на АГ та ЦД мають контролювати свій АТ у домашніх умовах (рівень доказовості B) (Bobrie et al., 2001; Sega et al., 2005; Omboni et al., 2013).
Цілі лікування
У пацієнтів із ЦД та АГ необхідно визначити індивідуальні цільові показники АТ шляхом прийняття спільного рішення з огляду на СС-ризик, можливі несприятливі ефекти антигіпертензивних препаратів та побажання пацієнта (рівень доказовості С). У хворих даної групи із вищою імовірністю СС-подій (наявне АССЗ або 10-річний ризик ≥15%) цільовий рівень АТ становить <130/80 мм рт. ст. за можливості безпечного досягнення (рівень доказовості С).
В осіб із ЦД та АГ з нижчою імовірністю СС-ускладнень (10-річний ризик АССЗ <15%) слід досягти цільового АТ <140/90 мм рт. ст. (рівень доказовості А). У вагітних із ЦД та раніше виявленою АГ цільове значення АТ має становити ≤135/85 мм рт. ст. для зниження ризику злоякісної АГ (рівень доказовості А) та мінімізації порушень розвитку плода (рівень доказовості Е) (Ettehad et al., 2016; Thomopoulos et al., 2017; Xie et al., 2016).
Результати стандартного й інтенсивного контролю АТ в осіб із ЦД у межах рандомізованих контрольованих досліджень (РКД), клінічні переваги та ризики представлені у таблиці.
Терапевтичні стратегії
Модифікація способу життя
Модифікація способу життя є важливою складовою лікування АГ, оскільки допомагає знизити АТ, підвищує ефективність деяких антигіпертензивних препаратів, сприяє іншим аспектам нормального обміну речовин та стану судин. Для пацієнтів з АТ >120/80 мм рт. ст. необхідні зміни способу життя включають зменшення маси тіла за надмірної ваги або ожиріння, спеціальний режим харчування, що передбачає антигіпертензивний ефект дієти (DASH), а саме зменшення споживання солі та збільшення – калію, помірне вживання алкоголю та підвищення фізичної активності (рівень доказовості А). План модифікації способу життя повинен бути розроблений спільно лікарем та пацієнтом й обговорюватися як частина лікування ЦД (Sacks et al., 2001; James et al., 2014).
Фармакологічні втручання
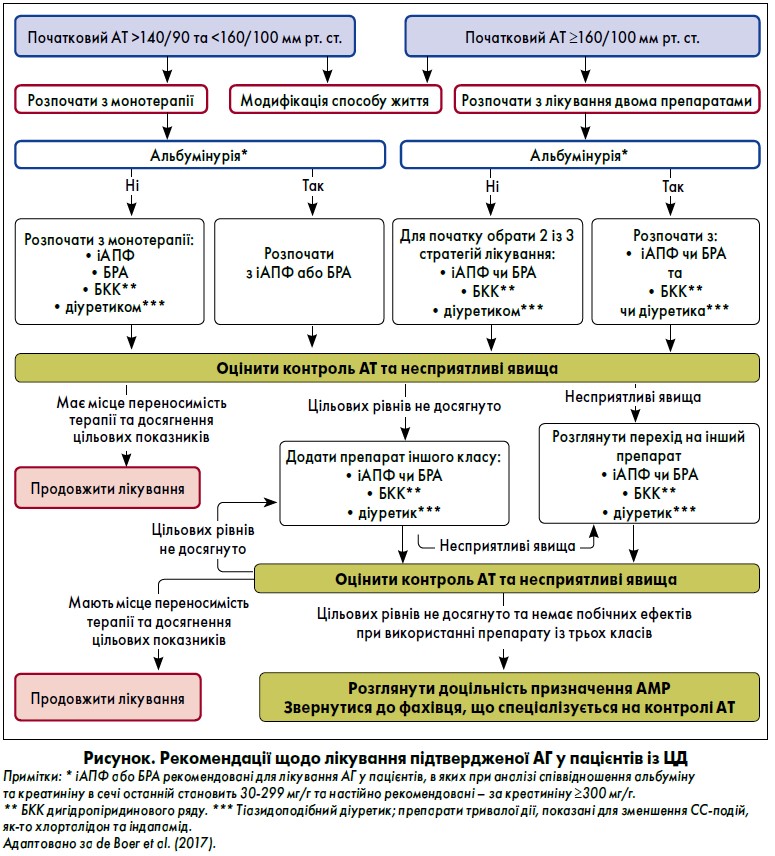
Початкове лікування хворих на ЦД залежить від тяжкості АГ (рисунок) (Bakris et al., 2009; Webster et al., 2018). Пацієнтам із підтвердженим офісним АТ ≥140/90 мм рт. ст., окрім коригування способу життя, слід швидко призначити фармакотерапію при своєчасному титруванні доз препаратів для досягнення цільового АТ (рівень доказовості А). В осіб із підтвердженим офісним АТ ≥160/100 мм рт. ст., на додачу до модифікації способу життя, потрібен швидкий початок медикаментозного лікування зі своєчасним титруванням доз двох препаратів або комбінації ліків в одній таблетці, що продемонстрували зменшення СС-подій у хворих на ЦД (рівень доказовості А) (Bangalore et al., 2007).
Терапія АГ має включати класи лікарських засобів, що здатні знижувати СС-ускладнення у пацієнтів із ЦД, як-то інгібітори ангіотензинперетворювального ферменту (іАПФ), блокатори рецепторів ангіотензину (БРА), тіазидоподібні діуретики або блокатори кальцієвих каналів (БКК) дигідропіридинового ряду (рівень доказовості А) (Catala-Lopez et al., 2016; Palmer et al., 2015; Weber et al., 2010). Для досягнення цільового рівня АТ зазвичай необхідне застосування комплексної терапії. Однак не рекомендоване сумісне використання іАПФ/БРА та комбінації іАПФ або БРА із прямими інгібіторами реніну через відсутність додаткової користі щодо зменшення СС-подій та ймовірність зростання частоти побічних ефектів, як-от гіперкаліємія, синкопе та гостре ураження нирок (рівень доказовості А) (Yusuf et al., 2008; Fried et al., 2013; Makani et al., 2013).
Інгібітор АПФ або БРА у максимально переносимому дозуванні для лікування АТ є рекомендованою терапією АГ першої лінії у пацієнтів із ЦД, коли при аналізі співвідношення альбуміну та креатиніну в сечі останній становить ≥300 мг/г (рівень доказовості А) або 30‑299 мг/г (рівень доказовості В). Для осіб з альбумінурією (співвідношення альбуміну та креатиніну в сечі ≥30 мг/г) початкове лікування має включати іАПФ або АРБ, щоб знизити ризик розвитку прогресувальної хвороби нирок (de Boer et al., 2017).
Якщо спостерігається непереносимість одного класу препаратів, його слід замінити на інший (рівень доказовості В). У пацієнтів, які отримують лікування іАПФ, БРА або діуретиком, варто контролювати рівень креатиніну / розрахункову швидкість клубочкової фільтрації (ШКФ) та вміст калію у сироватці крові принаймні щороку (рівень доказовості В).
Пацієнти з резистентною АГ
Резистентна АГ визначається як АТ ≥140/90 мм рт. ст. незважаючи на терапевтичний підхід, що включає модифікацію способу життя, застосування діуретика та двох інших антигіпертензивних засобів різних класів в адекватних дозах. Перш ніж діагностувати резистентну АГ, слід виключити низку інших станів, зокрема недотримання режиму лікування, АГ білого халату та вторинну АГ. Загалом слід виявити та усунути перешкоди, що заважають належному комплаєнсу, з-поміж яких висока вартість ліків, побічні ефекти.
У пацієнтів з АГ, в яких не вдається досягти цільового рівня АТ за приймання трьох класів антигіпертензивних препаратів (включно з діуретиками), слід розглянути доцільність лікування антагоністами мінералокортикоїдних рецепторів (АМР) (рівень доказовості В) (Iliescu et al., 2015). Останні також зменшують альбумінурію та мають додаткові СС-переваги (Bakris et al., 2015; Williams et al., 2015; Filippatos et al., 2016). Однак додавання АМР до лікування, що включає іАПФ або БРА, може підвищити ризик гіперкаліємії. Це підкреслює важливість регулярного моніторингу рівня креатиніну та калію в сироватці крові пацієнтів.
Контроль рівня ліпідів у крові
Для зниження факторів ризику розвитку АССЗ пацієнтам рекомендовано модифікацію способу життя з акцентом на втраті ваги (за наявності показань), застосування середземноморської дієти або DASH, зменшення споживання насичених і трансжирів та збільшення – ненасичених жирних кислот омега‑3, в’язкої розчинної клітковини, рослинних станолів/стеринів (Jensen et al., 2014; Estruch et al., 2018). Також хворим на ЦД доцільно підвищити фізичну активність для поліпшення ліпідного профілю та зниження ризику розвитку АССЗ (рівень доказовості А). На додаток, в осіб із підвищеним рівнем тригліцеридів (ТГ; ≥150 мг/дл, чи 1,7 ммоль/л) та/або низьким ХС ліпопротеїнів високої щільності (ЛПВЩ) (<40 мг/дл, чи 1,0 ммоль/л для чоловіків і <50 мг/дл, або 1,3 ммоль/л для жінок) необхідними є значне коригування способу життя та оптимізування контролю глікемії (рівень доказовості С) (Eckel et al., 2013).
У дорослих пацієнтів, які не отримують статинів або іншої гіполіпідемічної терапії, доцільно проводити контроль ліпідного профілю під час діагностики ЦД, при першому медичному обстеженні та кожні п’ять років, якщо вони молодше 40 років, або частіше за наявності показань (рівень доказовості Е). Крім того, моніторинг ліпідного профілю необхідний на початку приймання статинів або інших ліпідознижувальних препаратів, через 4‑12 тижнів після нього або у разі зміни дозування, а також надалі щорічно, оскільки це допоможе контролювати відповідь на терапію та інформуватиме про комплаєнс (рівень доказовості Е) (Chasman et al., 2004; Meek et al., 2012).
Лікування статинами
Первинна профілактика
У хворих віком 40‑75 років, що страждають на ЦД без АССЗ на додаток до модифікації способу життя рекомендовано застосовувати статинотерапію помірної інтенсивності (рівень доказовості А) (Collins et al., 2003; Taylor et al., 2013; Carter et al., 2013). У пацієнтів віком 20‑39 років із ЦД з додатковими факторами ризику розвитку АССЗ може бути доцільним розпочати лікування статинами разом із коригуванням способу життя (рівень доказовості С) (Mihaylova et al., 2012; Baigent et al., 2005).
В осіб із ЦД групи підвищеного ризику, особливо тих, хто має множинні чинники ризику АССЗ або віком 50‑70 років, доцільною є високоінтенсивна статинотерапія (рівень доказовості В) (Baigent et al., 2010). У дорослих пацієнтів із ЦД та 10-річним ризиком виникнення АССЗ ≥20% слід розглянути додавання езетимібу до максимально переносимих доз статинів для зниження рівня ХС ЛПНЩ на ≥50% (рівень доказовості С) (Grundy et al., 2019).
Вторинна профілактика
У пацієнтів будь-якого віку із ЦД та АССЗ до модифікації способу життя доцільно додати високоінтенсивну статинотерапію (рівень доказовості А) (Zinman et al., 2015; Cannon et al., 2004, 2015). В осіб із ЦД та АССЗ, які входять до групи дуже високого ризику та мають ХС ЛПНЩ ≥70 мг/дл при використанні статину в максимально переносимій дозі, варто розглянути проведення додаткової терапії для зниження рівня ЛПНЩ (наприклад, езетимібом або інгібітором PCSK9) (Sabatine et al., 2017; Giugliano et al., 2018). Езетиміб може мати переваги через нижчу вартість. У хворих із непереносимістю високоінтенсивного лікування слід застосовувати статини в максимально переносимій дозі (рівень доказовості Е).
У пацієнтів >75 років із ЦД, які вже перебувають на терапії статинами, доцільно її продовжувати (рівень доказовості В). Якщо хворі даної вікової категорії ще не отримують лікування статинами, слід розглянути початок терапії після обговорення потенційних переваг та ризиків (рівень доказовості С). У разі вагітності застосування статинів протипоказане (рівень доказовості В).
Комбінована терапія для зниження рівня ХС ЛПНЩ
У рандомізованому контрольованому дослідженні IMPROVE-IT за участю 18 144 пацієнтів віком ≥50 років, що нещодавно перенесли гострий коронарний синдром (ГКС), порівнювали додавання езетимібу до симвастатину порівняно з монотерапією симвастатином. Сумісне застосування езетимібу асоціювалося з відносним поліпшенням на 6,4% та абсолютним зменшенням основних несприятливих СС-подій на 2%. При цьому ступінь покращання був прямо пропорційним зміні рівня ХС ЛПНЩ, який в середньому становив 70 мг/дл при використанні симвастатину та 54 мг/дл у комбінованій групі (Cannon et al., 2015). У хворих на ЦД (27% учасників) поєднання симвастатину в середній дозі (40 мг) та езетимібу (10 мг) продемонструвало значне зниження частоти основних СС-подій при абсолютному зменшенні ризику на 5% та відносному – на 14% порівняно із симвастатином у середній дозі (40 мг) (Giugliano et al., 2018).
У плацебо-контрольованих дослідженнях оцінки додавання інгібіторів PCSK9 еволокумабу та алірокумабу до статинів у максимально переносимих дозах пацієнтам, які мали високий ризик розвитку АССЗ, спостерігалося помірне зниження рівня ХС ЛПНЩ (36‑59%). Ці препарати схвалені як допоміжна терапія для пацієнтів з АССЗ або сімейною гіперхолестеринемією, що отримують статини, але потребують додаткового зменшення ХС ЛПНЩ (Moriarty et al., 2014; Zhang et al., 2015). У рандомізоване випробування FOURIER були залучені 27 564 осіб із раніше виявленим АССЗ та високим ризиком, що отримували лікування статинами у максимально переносимих дозах, але все ще мали ХС ЛПНЩ ≥70 мг/дл або ХС не-ЛПВЩ ≥100 мг/дл (Sabatine et al., 2015). Результатом застосування підшкірних ін’єкцій еволокумабу (140 мг кожні два тижні або 420 мг щомісяця) порівняно із плацебо було зниження рівня ХС ЛПНЩ на 59% у групі еволокумабу. Під час середнього періоду спостереження 2,2 року сукупні наслідки у вигляді СС-смерті, ІМ, інсульту, госпіталізації з приводу стенокардії або реваскуляризацій мали місце у 11,3 і 9,8% у групах плацебо та еволокумабу відповідно, що становило зниження відносного ризику на 15%. Комбінована кінцева точка СС-смерті, ІМ та інсульту зменшилася на 20%. Важливо зазначити, що подібні переваги спостерігалися у підгрупі пацієнтів із ЦД, яка включала 11 031 особу (Sabatine et al., 2017).
Не було показано, що комбінована терапія статином та фібратом покращує наслідки АССЗ, тому її зазвичай не рекомендовано призначати (рівень доказовості А) (Jones, Davidson, 2005; Ginsberg et al., 2010). Крім того, не отримано доказів, що сумісне використання статину та ніацину забезпечує додаткову СС-користь порівняно із терапією лише статинами, а також може збільшити ризик розвитку інсульту з побічними ефектами, тому зазвичай не рекомендоване (рівень доказовості А) (Boden et al., 2011; Landray et al., 2014).
Інші мішені терапії
У хворих із рівнем ТГ натще ≥500 мг/дл слід оцінити вторинні причини гіпертригліцеридемії та розглянути можливість призначення фармакотерапії для зниження ризику панкреатиту (рівень доказовості С) (Berglund et al., 2012). У дорослих пацієнтів із помірною гіпертригліцеридемією (ТГ натще або ні 175‑499 мг/дл) потрібно враховувати й контролювати фактори способу життя (ожиріння, метаболічний синдром), вторинні чинники (ЦД, хронічні захворювання печінки чи нирок та/або нефротичний синдром, гіпотиреоз), а також звертати увагу на ліки, що підвищують ТГ (рівень доказовості С). У хворих на АССЗ або з іншими факторами СС-ризику, контрольованим ХС ЛПНЩ, але підвищеним вмістом ТГ (135‑499 мг/дл), які отримують статини, можна розглянути додавання ікозапент етилу для зниження СС-ризику (рівень доказовості С).
Антитромбоцитарна терапія
Показано, що ацетилсаліцилова кислота (АСК) є ефективною та настійно рекомендована для зменшення СС-захворюваності та смертності у пацієнтів із високим ризиком, що перенесли ІМ або інсульт (вторинна профілактика). У первинній профілактиці хворих без попередніх СС-подій переваги є дещо суперечливими (Baigent et al., 2009; Perk et al., 2012).
Лікування АСК у дозі 75‑162 мг/добу слід використовувати як стратегію вторинної профілактики у хворих на ЦД та АССЗ в анамнезі (рівень доказовості А). У пацієнтів з АССЗ та підтвердженою алергією на АСК слід застосовувати клопідогрель (75 мг/добу) (рівень доказовості В). Подвійна антитромбоцитарна терапія (АСК у низьких дозах та інгібітором рецепторів P2Y12) є доцільною протягом року після ГКС (рівень доказовості А) і може мати переваги після цього періоду (рівень доказовості В) (Vandvik et al., 2012).
Терапію АСК (75‑162 мг/добу) можна розглядати як основну стратегію профілактики хворих на ЦД, які мають підвищений СС-ризик, після обговорення з пацієнтом переваг лікування з урахуванням підвищеного ризику кровотечі (рівень доказовості А) (Pignone et al., 2006).
Пацієнти із ССЗ та ЦД
У безсимптомних пацієнтів рутинний скринінг щодо наявності ІХС не рекомендований, частково тому, що хворі з високим ризиком вже повинні отримувати інтенсивну фармакотерапію, яка забезпечує подібну до інвазивної реваскуляризації користь (рівень доказовості А) (Bax et al., 2006; Boden et al., 2007). Слід розглянути можливість обстеження із приводу розвитку ІХС, якщо у пацієнта виявлено: атипові кардіальні симптоми (як-то безпричинна задишка, дискомфорт у грудях), ознаки або симптоми супутніх судинних патологій, зокрема шуму над сонною артерією, транзиторної ішемічної атаки, інсульту, захворювання периферичних артерій тощо, або аномалії на електрокардіограмі (наприклад, зубці Q) (рівень доказовості Е). У пацієнтів зі встановленим АССЗ доцільно розглянути лікування іАПФ чи БРА, щоб зменшити ризик СС-подій (рівень доказовості В). У разі наявності інфаркту міокарда в анамнезі потрібно продовжувати приймати β-блокатори принаймні два роки після події (рівень доказовості В) (Braunwald et al., 2004; Kezerashvili et al., 2012).
В осіб із ЦД 2-го типу та стабільною СН можна продовжувати застосування метформіну для зниження рівня глюкози, якщо розрахункова ШКФ лишається >30 мл/хв (Eurich et al., 2005). Проте варто уникати його призначення у нестабільних або госпіталізованих хворих на СН (рівень доказовості В). У пацієнтів із ЦД 2-го типу з підтвердженим АССЗ або захворюванням нирок рекомендовано використовувати інгібітор натрій-глюкозного котранспортера 2-го типу (SGLT2) або агоніст рецепторів глюкагоноподібного пептиду 1 (GLP‑1) із доведеною ефективністю при ССЗ як частину режиму глюкозознижувальної терапії (рівень доказовості А) (Perkovic et al., 2019; Neal et al., 2017; Wiviott et al., 2019).
У пацієнтів із ЦД 2-го типу та встановленими АССЗ / множинними факторами ризику їхнього розвитку або діабетичною хворобою нирок доцільно застосовувати інгібітори SGLT2 із продемонстрованою користю при ССЗ для зниження ризику серйозних несприятливих СС-подій та госпіталізації з приводу СН (рівень доказовості А) (Husain et al., 2019; Gerstein et al., 2019; Holman et al., 2017; Zelniker et al., 2019).
Підготувала Олена Коробка
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (73) 2020 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....