Механізми та клінічні ефекти леветирацетаму: від молекул до систем
 Леветирацетам був схвалений на початку 2000-х років як протинападовий препарат (ПНП) у США, ЄС, після чого стрімко досягнув позначки в 200 000 пацієнто-років терапії до кінця 2002 року. Леветирацетам – ПНП ІІ покоління, який продемонстрував кращу переносимість і поліпшену ефективність порівняно з іншими ПНП, отже, поступово вийшов на позицію першого вибору при лікуванні різних форм епілепсії [1].
Леветирацетам був схвалений на початку 2000-х років як протинападовий препарат (ПНП) у США, ЄС, після чого стрімко досягнув позначки в 200 000 пацієнто-років терапії до кінця 2002 року. Леветирацетам – ПНП ІІ покоління, який продемонстрував кращу переносимість і поліпшену ефективність порівняно з іншими ПНП, отже, поступово вийшов на позицію першого вибору при лікуванні різних форм епілепсії [1].
Клінічні показання за епілепсії
Нині леветирацетам є препаратом широкого спектру дії, який використовується окремо та разом з іншими ПНП для контролю як фокальних, так і генералізованих епілептичних нападів [2, 3]. У 1999 році Управлінням з контролю за якістю продуктів харчування та лікарських засобів США (FDA) схвалено використання препарату для перорального застосування як допоміжної терапії з метою лікування нападів із фокальним початком, міоклонічних і первинно генералізованих нападів. Леветирацетам для внутрішньовенного введення схвалено FDA в 2006 році як додаткову протисудомну терапію, коли пероральне введення тимчасово неможливе. Європейською агенцією з лікарських засобів (EMA) схвалено його використання в 2000 році в режимі монотерапії для лікування вогнищевих нападів і фокальних нападів із переходом у двобічні тоніко-клонічні судоми (раніше відомих як парціальні напади і парціальні напади вторинно генералізовані відповідно), а також як додаткове лікування нападів із фокальним початком, міоклонічних нападів, генералізованих тоніко-клонічних нападів. Леветирацетам також продемонстрував високу ефективність у пацієнтів із рефлекторними нападами [4] та, ймовірно, є найкращим із нових ПНП для лікування ювенільної міоклонічної епілепсії через високу й тривалу ефективність [5].
Лікарські форми та дозування
Леветирацетам доступний у формах для перорального та внутрішньовенного введення. Доза для монотерапії фокальних нападів і фокальних нападів із переходом у двобічні тоніко-клонічні судоми становить від 500 мг 2 р/день до максимальної дози 3 г/день. У цьому діапазоні доз леветирацетам є ефективним ПНП як для дорослих, так і для дітей з генералізованими чи фокальними рефрактерними нападами [6]. У новонароджених доза від 20 до 60 мг/кг/добу призначається для лікування неонатальних судом [7]. Окрім того, в новонароджених і дітей, які раніше не отримували ПНП, леветирацетам у дозі 20-60 мг/кг/добу застосовується при ідіопатичних генералізованих тоніко-клонічних нападах [8]. Леветирацетам внутрішньовенно в дозі 500-2000 мг/добу застосовують за трьох основних станів: епілептичний статус, повторювані гострі симптоматичні та післяопераційні напади [9].
Клінічна ефективність при епілепсії
Дорослі
Загалом проведено >130 клінічних випробувань леветирацетаму в лікуванні епілепсії, з яких 90 завершено [10]. Серед перших було дослідження Cereghino та співавт., які виявили в 38-тижневому багатоцентровому подвійному сліпому рандомізованому протоколі, що додаткова терапія леветирацетамом зменшує частоту нападів у пацієнтів із рефрактерною фокальною епілепсією [11]. В європейському рандомізованому подвійному сліпому контрольованому дослідженні леветирацетам оцінювали протягом 12 тиж як додаткову терапію в дозах 1000 (500 мг 2 р/день) і 2000 мг/добу (1000 мг 2 р/день) проти плацебо в хворих із рефрактерною епілепсією. Результати показали зниження частоти нападів у 22,8% пацієнтів у групі 1000 мг і 31,6% хворих групи 2000 мг порівняно з 10,4% пацієнтів у групі плацебо [12]. Багатоцентрове рандомізоване подвійне сліпе дослідження Ben-Menachem і Falter порівнювало підтримувальну дозу 3000 мг леветирацетаму щодня протягом 12 тиж із додатковим плацебо у 286 пацієнтів віком 16-70 років із фокальною епілепсією, що складно лікувалася. Зі 181 пацієнта групи леветирацетаму 36 обрано для переходу на фазу монотерапії. Результати в групі монотерапії продемонстрували зниження частоти нападів із фокальним початком, а 9 пацієнтів (18,4%) цілком позбулися нападів, а це свідчить про те, що перехід на підтримувальну монотерапію є ефективним і добре переноситься хворими з рефрактерною фокальною епілепсією, які спочатку відповіли на додаткову терапію леветирацетамом у дозі 3000 мг/день [35].
Діти та підлітки
Генералізовані тоніко-клонічні напади – поширений тип нападів при епілепсії у дітей; лікування леветирацетамом показало сприятливі результати в педіатричних пацієнтів із цим різновидом нападів [8]. Хорошу клінічну відповідь на леветирацетам також спостерігали при генетично зумовленій епілепсії з раннім початком як у доношених, так і в недоношених немовлят [14, 15]. У відкритому дослідженні додаткова терапія леветирацетамом у дозі 20-40 мг/кг/день у дітей віком 6-12 років із резистентними до лікування фокальними нападами була ефективною та безпечною [16]. В іншому випробуванні в немовлят і дітей молодшого віку (від 1 міс до <4 років) із фокальними нападами, які недостатньо контролювалися за допомогою 1 або 2 ПЕП, леветирацетам як допоміжна терапія (40,5-50,5 мг/кг/день) підвищував ефективність лікування та добре переносився [17]. В нещодавньому клінічному дослідженні, проведеному за участю 54 дітей віком від 2 до 15 років з епілептичними розрядами на електроенцефалограмі (ЕЕГ) і клінічними нападами, контрольованими вальпроатом, леветирацетам у дозі 50 мг/кг додавали до терапії для зменшення аномалій ЕЕГ. В обох групах (вальпроат окремо та в комбінації з леветирацетамом) зменшилася виразність епілептичних розрядів, проте додавання леветирацетаму нормалізувало ЕЕГ швидше [18].
Епілептичний статус – це невідкладний стан, за якого напади тривалістю >30 хв можуть бути фатальними. За даними 2 метааналізів встановлено значущу ефективність леветирацетаму для припинення судом у пацієнтів з епілептичним статусом [19, 20]. Ґрунтуючись на цьому (найвищому) рівні доказів, деякі експерти розглядають леветирацетам як перший варіант терапії другої лінії при лікуванні епілептичного статусу (препаратами першої лінії наразі є бензодіазепіни) [21]. Безсумнівною перевагою леветирацетаму є сприятливіший профіль безпеки. Леветирацетам не чинить відомих серйозних побічних ефектів на системи органів, навіть при застосуванні високих доз [22], а також загалом спостерігається менше побічних реакцій, ніж від інших поширених ПНП [23].
Інші клінічні застосування
Під час проведення деяких випробувань виявлено терапевтичний потенціал леветирацетаму поза схваленими показаннями для лікування епілепсії. Зокрема, він має антигіпералгетичну та протизапальну активність, тому вивчається як альтернативний засіб для лікування невропатичного болю. Rossi та Falah і співавт. повідомили про сприятливий ефект леветирацетаму (3000 мг/день протягом 6 тиж) у контролі симптомів центрального невропатичного болю в пацієнтів із розсіяним склерозом [24, 25]. Brighina та співавт. виявили, що леветирацетам у дозі 1000 мг/день протягом 6 міс полегшує біль у пацієнтів із мігренню [26]. В дослідженні Hamza та співавт. установлено ефективність леветирацетаму (спочатку 500 мг 2 р/день протягом 2 тиж, потім 750 мг 2 р/день упродовж 2 тиж, а згодом до 1500 мг 2 р/день) у зменшенні болю при хронічній поперековій радикулопатії [27].
Awaad і співавт. оцінювали вплив леветирацетаму на голосовий тик у дітей і підлітків із тиками та синдромом Туретта. Початкова доза становила 250 мг/добу, потім її титрували протягом 3 тиж до 1000-2000 мг/добу. Дослідники дійшли висновку, що леветирацетам може бути корисним для лікування тиків у дітей і підлітків [28]. Wang і співавт. повідомили, що леветирацетам у дозі 60 мг/кг/день курсом 6 міс покращує поведінку та когнітивні функції у педіатричних пацієнтів із розладом аутистичного спектра [29]. Jabbarli та співавт. виявили, що леветирацетам чинить протипухлинний ефект при гліобластомі, а також показали, що періопераційне лікування леветирацетамом пов’язувалося із тривалішим загальним виживанням і виживанням без прогресування [30].
Отже, леветирацетам – перспективний препарат для лікування широкого спектру патологій і деяких симптомів, незалежних від епілепсії та судом. Терапевтична репозиція цієї цікавої молекули потребує подальших досліджень, але вже сьогодні можна краще зрозуміти переваги і перспективи леветирацетаму, зосередившись на його механізмах дії.
Будова молекули, фармакокінетика
Леветирацетам – водорозчинний S‑енантіомер етилового аналога пірацетаму. Але за профілем взаємодії з різними рецепторами в ЦНС молекула суттєво відрізняється від класу рацетамів [1, 3]. Крім того, леветирацетам має численні переваги серед інших ПНП, зокрема майже повна біодоступність і зв’язування з білками менше ніж на 20%, що не впливає на зв’язування з білками інших ліків. Леветирацетам характеризується швидкою та необмеженою дифузією через гематоенцефалічний бар’єр (ГЕБ). Метаболізм не залежить від печінкової системи цитохрому P450 (CYP), що зумовлює мінімальні ризики взаємодій з іншими ліками та робить його прийнятним для пацієнтів із печінковою дисфункцією. Леветирацетам переважно виводиться в незміненому вигляді з сечею, а на 24% перетворюється в неактивний метаболіт; період напіввиведення становить 9 год [31].
Молекулярні механізми дії
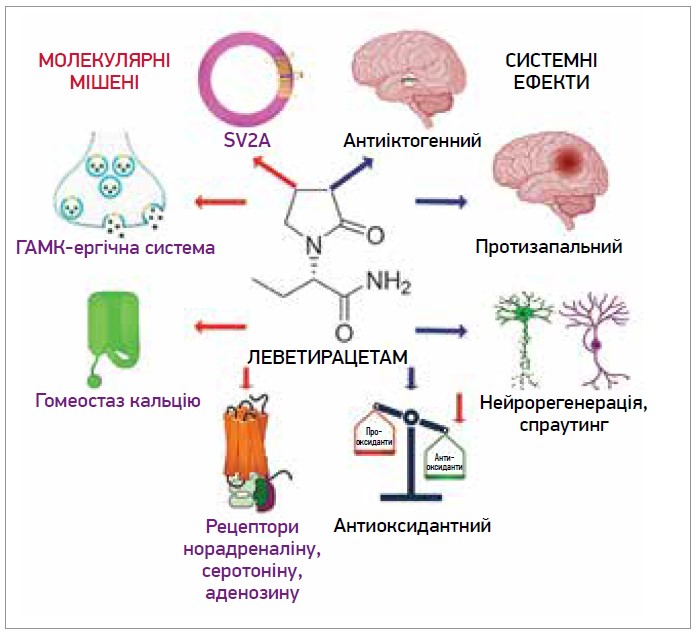
Згідно з даними численних доклінічних досліджень модуляція синаптичного везикулярного білка (SV2A) є основним механізмом дії леветирацетаму. SV2A – інтегральний мембранний білок, який міститься у везикулах майже всіх синаптичних закінчень і відіграє важливу роль як регулятор процесів екзоцитозу та ендоцитозу везикул. Цикл утворення синаптичних везикул має прямий стосунок до процесу вивільнення різних нейромедіаторів до синаптичної щілини [3].
Після надходження до кровотоку леветирацетам дифундує крізь ГЕБ і досягає паренхіми мозку. Потім він може дифундувати через нейрональну мембрану та/або зв’язуватися із внутрішньопросвітною поверхнею SV2A під час циклу синаптичних везикул. Обидва механізми не виключають один одного і навіть можуть бути синергічними. Леветирацетам здатен зменшити функцію SV2A під час везикулярного праймінгу, обмеживши пул везикул, що легко вивільняється, отже, й модулює вивільнення нейромедіаторів. Інший механізм полягає у тому, що леветирацетам стабілізує SV2A і покращує його функцію під час екзоцитозу й ендоцитозу, модулюючи експресію та рух білка синаптотагміну [3].
Інші молекулярні мішені леветирацетаму включають альфа-аміно‑3-гідрокси‑5-метил‑4-ізоксазол пропіонову кислоту (AMPA), норадреналінові, аденозинові та серотонінові рецептори, систему гомеостазу кальцію, систему гамма-аміномасляної кислоти (ГАМК). Леветирацетам блокує потенціал-залежні кальцієві канали, зменшуючи синаптичну передачу, а також зменшує калієві струми, викликаючи зменшення генерації повторюваного потенціалу дії. Що стосується кальцієвих внутрішньоклітинних систем, то леветирацетам пригнічує кальцієві перехідні процеси ріанодину та рецепторів IP3. У ГАМК‑ергічній системі леветирацетам модулює залежну від регіону декарбоксилазу глутамінової кислоти (GAD), підвищує рівень ГАМК‑трансамінази (GABA-T). У постсинаптичному відділі нейрона леветирацетам блокує дію антагоністів ГАМК‑рецепторів. У глутаматергічному синапсі леветирацетам модулює рецептори AMPA, зменшує струм збудження. Леветирацетам також продемонстрував пряму чи опосередковану взаємодію з рецепторами норадреналіну (2A і 2C), аденозину (A1), серотоніну (5-HT1B/1D), що пояснює його антигіпералгетичну дію (рис. 1) [1, 3, 32].
Рис. 1. Молекулярні мішені та системні ефекти леветирацетаму
Генетичні механізми
Численні доклінічні дослідження свідчать про те, що протиепілептична активність леветирацетаму може бути пов’язана з модифікацією експресії різноманітних генів. На моделі кіндлінгу (подразнення) мигдалеподібного тіла в щурів виявлено підвищення в гіпокампі рівнів мРНК нейротрофічного фактора мозку (BDNF) і нейропептиду Y (NPY). Лікування леветирацетамом протягом 12 днів зменшило рівні відповідних мРНК, чинило явний протисудомний ефект [33]. Крім того, за допомогою кількісної полімеразної ланцюгової реакції у режимі реального часу було підтверджено, що в скроневій частці тварин зі збудженою мигдалиною підвищується експресія гена NPY та інших генів, пов’язаних з епілепсією, як-от гени тиреотропін-рилізинг-гормона і гліального фібрилярного кислого білка (GFAP), а також те, що ці процеси частково нормалізувалися під впливом леветирацетаму [33]. В іншому експерименті на моделі кіндлінгу введення леветирацетаму за 1 год до стимуляції послабило гіперекспресію в гіпокампі генів медіаторів запалення – фактора некрозу пухлини (TNF) і циклооксигенази 2 типу (ЦОГ‑2). Зниження експресії обох генів відбувалося паралельно із протисудомним ефектом препарату [34]. Крім того, леветирацетам при введенні щодня протягом 1 тиж знижував рівні експресії інтерлейкіну‑1 (IL‑1) і рецептора інтерлейкіну‑1 підтипу I, а також зменшував пов’язаний з ними реактивний гліоз у гіпокампі та грушоподібній корі щурів з епілепсією [35].
Антиіктогенний ефект
Леветирацетам – унікальний ПНП, який поєднує декілька механізмів дії. Він відрізняється від класичних ПНП (вальпроєвої кислоти, фенобарбіталу, бензодіазепінів), оскільки не має спорідненості з такими класичними шляхами їхньої дії, як модуляція натрієвих каналів, низькопотенціальних кальцієвих каналів (T‑типу) і пряме посилення ГАМК‑трансмісії [3, 36]. Вибіркова дія леветирацетаму, спрямована на захист від судом у хронічних моделях епілепсії, також відрізняє його від інших ПНП, які діють як на нормальних, так і на епілептичних тварин. Ця селективність леветирацетаму пов’язана з іншими механізмами дії, які зумовлюють інгібування залпових імпульсів без перешкод для нормальної збудливості нейронів, що і запобігає переходу від міжнападової активності до іктальної. Отже, припускають, що леветирацетам переважно діє на нейрони, які демонструють аномальні моделі активності. Це, ймовірно, пояснює відсутність протисудомної дії проти гострих нападів [36] порівняно з його сильною протисудомною дією в хронічних моделях, а також унікальну переносимість і безпеку [37].
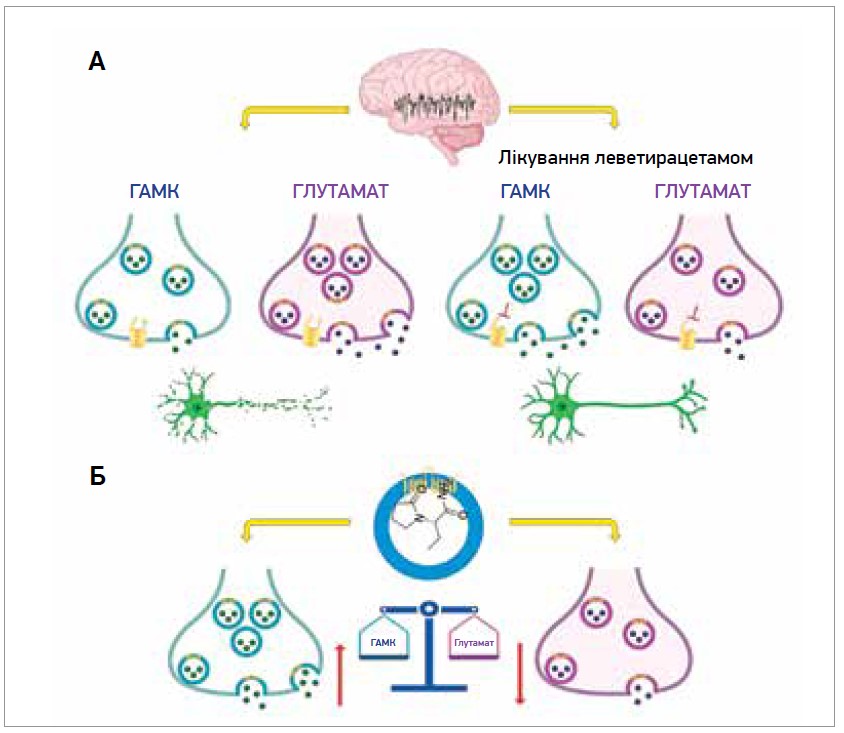
Антиіктогенний ефект леветирацетаму – інтегральний наслідок його взаємодії з різними мішенями, що спричиняє зниження збудливості в епілептичному колі (рис. 2а). Докази свідчать про те, що SV2A відіграє вирішальну роль [3]. У терміналі нейрона, задіяного в епілептичному колі, зв’язування леветирацетаму із SV2A може зумовити збільшення або зменшення вивільнення нейромедіаторів. ГАМК і глутамат є основними нейромедіаторами, відповідальними за підтримку балансу між гальмуванням і збудженням у ЦНС відповідно. За епілепсії виникає дисбаланс між цими системами, що спричиняє підвищену збудливість і загибель нейронів. Леветирацетам модулює обидві системи нейромедіаторів шляхом зв’язування із SV2A, що може зумовити збільшення вивільнення ГАМК або зменшення вивільнення глутамату. Незалежно від того, чи леветирацетам збільшує вивільнення ГАМК або зменшує вивільнення глутамату, кінцевими ефектами є зниження збудливості, пригнічення нападів і запобігання смерті нейронів завдяки відновленню балансу між збудливою та гальмівною системами [3] (рис. 2б).
Рис. 2. Антиіктогенний і нейропротекторний ефекти леветирацетаму
Антиепілептогенний ефект
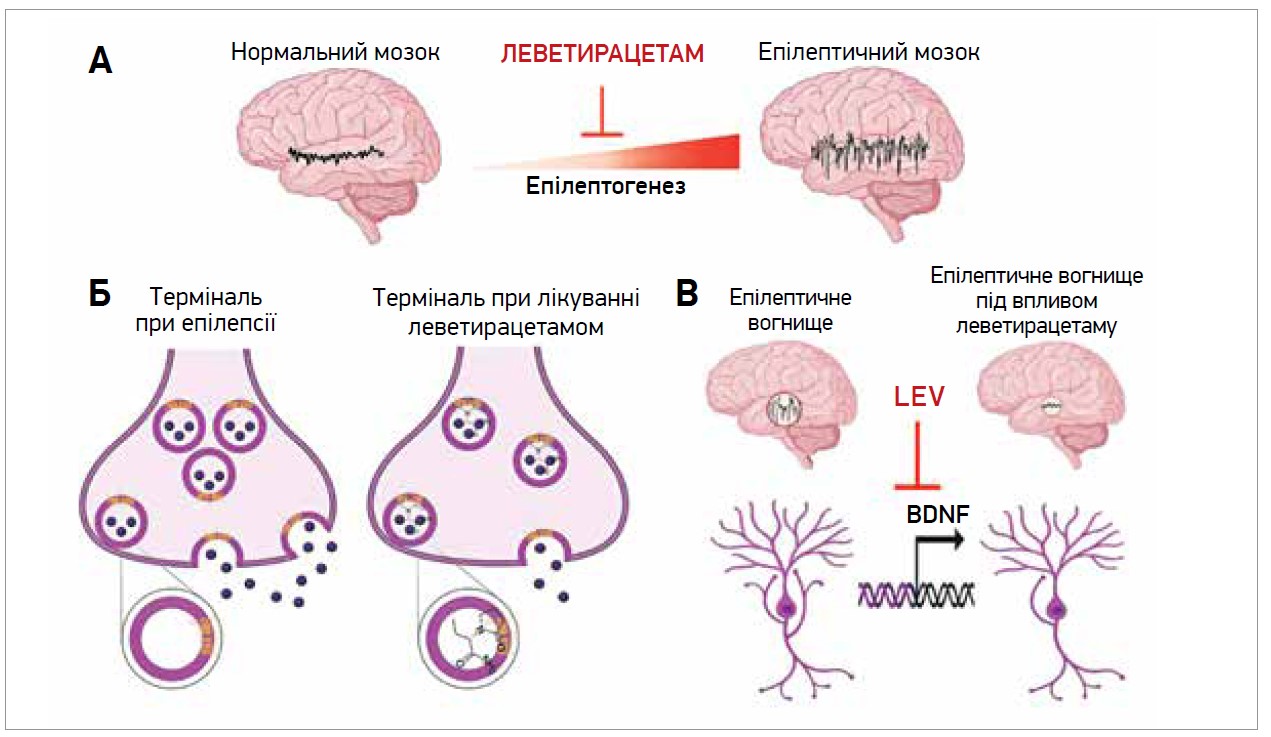
Леветирацетам – один із небагатьох ПНП, здатних сповільнювати чи пригнічувати генерацію нових епілептичних нейронних ланцюгів (рис. 3а). Потенційний антиепілептогенний і хворобомодифікуючий ефекти леветирацетаму підтверджено на моделях кіндлінгу та генетичної епілепсії [3]. Механізм, через який це відбувається, повністю не з’ясований, але, очевидно, пов’язаний з пригніченням надмірної синаптичної передачі. Зв’язування леветирацетаму із SV2A модулює ефекти SV2A, зменшуючи гіперзбудливість і стримуючи в такий спосіб епілептогенез (рис. 3б). Крім того, леветирацетам може інгібувати утворення епілептичних вогнищ пригніченням синтезу BDNF, отже, надмірне (мохоподібне) проростання нейронних відростків [3] (рис. 3в).
Рис. 3. Механізми антиепілептогенної активності леветирацетаму
Наразі леветирацетам не має клінічного показання для профілактичного лікування епілепсії, але деякі дослідження надали обнадійливі дані. В ретроспективному спостереженні пацієнтів, які приймали леветирацетам або фенітоїн протягом 1 року після супратенторіальної краніотомії, лікування леветирацетамом продемонструвало деяке зниження частоти нападів і менше ранніх побічних реакцій, ніж у групі фенітоїну [38]. Проспективне рандомізоване дослідження також виявило зниження частоти нападів за профілактичного застосування леветирацетаму в дозі 500 мг кожні 12 год до 7-го дня післяопераційного періоду [39]. Пацієнтам із черепно-мозковою травмою призначали леветирацетам у дозі 55 мг/кг щодня протягом 30 днів (із 8-го дня після травми). Через 2 роки в 5 із 46 пацієнтів групи леветирацетаму (10,9%) і у 8 із 40 хворих контрольної групи (20,0%) розвинулася посттравматична епілепсія, тобто леветирацетам знижував відносний ризик епілепсії на 53%, хоча різниця не досягла статистичної значущості [40].
Нейропротекція і протизапальний ефект
На додаток до непрямого нейропротекторного ефекту леветирацетаму через його вищезазначені антиіктогенні й антиепілептогенні механізми деякі експерименти демонструють прямий нейропротекторний вплив при різних патологічних станах мозку, наприклад, за ішемії, пов’язаної з посттравматичною епілепсією. Попереднє введення леветирацетаму щурам, ураженим каїновою кислотою, зумовило значне зниження загибелі нейронів зони CA1 гіпокампа; це було частково опосередковано інгібуванням перекисного окислення ліпідів [41]. Крім того, в нещодавньому дослідженні виявлено, що лікування леветирацетамом протягом 14 днів сприяло ангіогенезу та функціональному відновленню на моделі церебральної ішемії у щурів. Ці ефекти, ймовірно, опосередковані протизапальною та антиапоптотичною дією на додаток до індукції експресії білка теплового шоку 70 (HSP70), фактора росту судин VEGF і фактора 1, індукованого гіпоксією (HIF‑1) [42]. На моделях травми голови та крововиливу в субарахноїдальний простір використання леветирацетаму в мишей протягом 3 днів продемонструвало покращення вестибулярних і моторних функцій, а також зменшення гістологічних ознак ушкодження нейронів [43].
Механізми нейропротекції можуть бути пов’язані зі здатністю леветирацетаму модулювати вивільнення ГАМК і глутамату, оскільки за ішемічного ушкодження (як у разі епілепсії) спостерігається дисбаланс цих нейромедіаторів [3]. Вивільнення глутамату та його взаємодія з постсинаптичним N‑метил-D‑аспартатним рецептором (NMDA) посилює приплив іонів Ca2+ до клітин, запускаючи каскад подій, що лежить в основі їхньої загибелі, тому селективна блокада кальцієвих каналів може бути нейропротекторною. Леветирацетам регулює надходження кальцію до клітин шляхом блокування кальцієвих каналів підтипів N, P/Q і L [44]. Крім того, леветирацетам діє через рецептори ріанодину та IP3, пригнічуючи вивільнення Ca2+ [45]. Отже, леветирацетам може запобігти прогресуючому погіршенню епілепсії та захистити мозок від цитотоксичності й загибелі нейронів.
Епілептичні напади спричиняють активацію мікроглії, яка, своєю чергою, вивільняє прозапальні медіатори, як-от TNF, IL‑1β, IL‑6, тощо. Ці цитокіни сприяють ушкодженню ГЕБ і тривалому запаленню нейронів. Це спричиняє напади та нейродегенерацію, які, своєю чергою, активують подальше запалення, замикаючи хибне коло [3]. Протизапальний механізм леветирацетаму може бути пов’язаний з інгібуванням потенціал-залежних кальцієвих каналів, наявних у мікроглії. Леветирацетам також пригнічує сигнальний шлях янус-кінази JAK2-STAT3 і може діяти як інгібітор гістондеацетилази (HDAC), сприяючи транскрипції антиоксидантних і цитопротекторних генів, що допомагає підтримувати окислювально-відновний баланс [3].
Леветирацетам є унікальним протиепілептичним засобом із множинними молекулярними та генетичними механізмами дії, відмінними від ПНП І покоління, що з комплексного погляду пояснює його антиіктогенні, антиепілептогенні, нейропротекторні, антиоксидантні та протизапальні ефекти.
Довідка «ЗУ»
Завод Acino в Україні – «Фарма Старт» - сертифікований відповідно до стандартів належної виробничої практики GMP. До його продуктової лінійки входять препарати Левіцитам 250 і Левіцитам 500 (містять 250 або 500 мг леветирацетаму відповідно). Схвалені в Україні показання відповідають європейським. Левіцитам показаний у режимі монотерапії (препарат першого вибору) при лікуванні вогнищевих нападів із вторинною генералізацією або без такої у дорослих і дітей віком >16 років, у яких уперше діагностовано епілепсію.
Також Левіцитам показаний як додаткова терапія при лікуванні:
- фокальних нападів із вторинною генералізацією або без такої у дорослих і дітей віком >6 років, хворих на епілепсію;
- міоклонічних судом у дорослих і дітей віком >12 років, хворих на ювенільну міоклонічну епілепсію;
- первинно генералізованих судомних (тоніко-клонічних) нападів у дорослих і дітей віком >12 років, хворих на ідіопатичну генералізовану епілепсію.
Список літератури знаходиться в редакції.
За матеріалами: Contreras-Garcia I.J. et al. Levetiracetam Mechanisms of Action:
From Molecules to Systems. Pharmaceuticals (Basel). 2022 Apr; 15(4): 475.
UA-LEVI-PUB-012024-086
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (562-563), 2024 р
СТАТТІ ЗА ТЕМОЮ Неврологія
Стрес і тривожність чинять потужний несприятливий вплив і на самопочуття окремих індивідуумів, і на загальний стан здоров’я всієї популяції світу. Цей несприятливий вплив значно підсилили пандемія COVID‑19 та війна в Україні (Celuch M. et al., 2023)....
16-17 лютого в Києві відбувся науково-практичний майстер-клас «Хронічний стрес сьогодення: обрані запитання про здоров’я жінки в різні вікові періоди». Під час заходу виступили фахівці різних спеціальностей, було обговорено важливі аспекти жіночого здоров’я як психологічного, так і фізичного. Доповіді присвячувалися різноманітним питанням, зокрема репродуктивним проблемам, онкологічним захворюванням, психосоматичним розладам. Під час події виступила засновниця Академії довголіття Dr. Skytalinska, віцепрезидент Асоціації дієтологів України, лікар-дієтолог Оксана Василівна Скиталінська. Доповідь Оксани Василівни була присвячена впливу тривалого стресу на харчування та пов’язані з цим наслідки для здоров’я жінок. Окрім пояснення механізмів негативного впливу стресу, під час доповіді лікарка також надала важливі практичні рекомендації стосовно здорового харчування....
Події останніх 5 років є неабияким викликом для психічного стану кожного українця: спочатку – пандемія коронавірусу та запроваджені через неї карантинні обмеження, а далі – повномасштабне російське вторгнення, що триває уже понад 2 роки. Все це спричиняє погіршення психічного здоров’я населення. Такі надзвичайні ситуації, що характеризуються загрозою з невизначеною тривалістю, створюють масивне стресове навантаження, яке підсилюється відчуттям самотності та відчуженості, підвищують тривожність, а також є підґрунтям розвитку психічних розладів. Відомо, що ці стани порушують розумову діяльність, тобто перешкоджають концентрації та аналізу інформації. ...
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....