Сучасний стан проблеми діагностики та лікування орбітопатії Грейвса

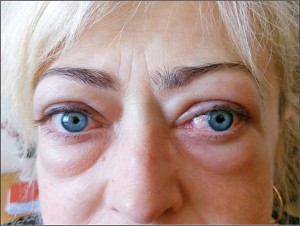
Орбітопатія Грейвса (ОГ) – основний екстратиреоїдний прояв хвороби Грейвса, що являє собою аутоімунне ураження тканин орбіти (ретробульбарної клітковини, м’язів та власне ока).
Ведення пацієнтів із ОГ є субоптимальним, адже лікування, що існує, не впливає на патогенетичні механізми розвитку цього захворювання. Лікування має обов’язково базуватися на ретельному визначенні активності та тяжкості процесу, а також на його впливі на якість життя пацієнта.
Місцеві заходи (штучні сльози, мазі, темні окуляри) та контроль за факторами ризику (паління та тиреоїдний статус) мають стосуватися кожного пацієнта. За легких проявів ОГ зазвичай достатньо активного спостереження, хоча 6-місячний курс препаратів селену ефективний у покращенні помірних симптомів та запобіганні прогресування хвороби у більш тяжкі форми. Терапією першого ряду для середньо-тяжких і активних форм ОГ є високодозова внутрішньовенна пульс-терапія глюкокортикоїдами, а їх кумулятивна доза у перерахунку на метилпреднізолон становить 4,5-5 г та може бути збільшена до 8 г у тяжких випадках.
У 2008 році був уперше опублікований консенсус, що стосувався цієї патології. Він був створений Європейською групою з вивчення орбітопатії Грейвса (EUGOGO) під егідою Європейської тиреоїдної асоціації (ETA). За останні декілька років було проведено декілька рандомізованих клінічних досліджень та накопичений достатній досвід для створення нової версії настанов щодо діагностики і лікування ОГ.
За даними популяційного дослідження зі Швеції, частота ОГ становить 42,2 на мільйон на рік (у 20,1% випадків гіпертиреозу). Це корелює з цифрами, отриманими у Данії, де частота середньо-тяжких і тяжких форм становила 16,1 на мільйон на рік. Частіше хворіють жінки (4-5:1) середнього віку (40-60 років). За більшістю досліджень середньо-тяжкі і тяжкі форми виникають у 5-6% випадків хвороби Грейвса.
Доведено, що основна кількість випадків легкої ОГ спонтанно зникне під час 18-місячної терапії антитиреоїдними препаратами. З часів публікації останнього консенсусу до спеціалізованих центрів у Європі звертаються пацієнти з менш активною і менш тяжкою орбітопатією, що може пояснюватися більш адекватним веденням пацієнтів з цією патологією. Зазначені настанови містять 17 пунктів із детальним обґрунтуванням, що базується на принципах доказової медицини.
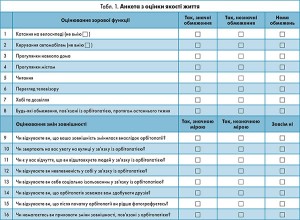
Важливим акцентом цих настанов стало прискіпливе відношення до якості життя пацієнта, адже за багатьма публікаціями ОГ прирівнюється до цукрового діабету або навіть певних форм раку за силою впливу на психічний стан пацієнта. Підбір оптимального лікувального плану значно покращує якість життя цієї групи хворих. Спеціальні адаптовані опитувальники з якості життя доступні онлайн на сайті EUGOGO декількома мовами. У таблиці 1 наведено переклад українською мовою. Перший блок питань (8 питань) стосується оцінювання зорових функцій, другий блок (8 питань) – оцінювання психологічних проблем, пов’язаних із змінами зовнішності. Кожна відповідь оцінюється бально, де 3 бали – відсутність обмеження, а 1 бал – значні обмеження. Кожен блок має проміжну оцінку від 8 до 24. Остаточний бал розраховують за формулою: (проміжний бал – 8)/16×100. Він може варіювати від 0 до 100, чим він вищий, тим кращий стан пацієнта.
1. Анкети щодо оцінки мають використовуватися у кожного пацієнта і впливати на вибір терапевтичної тактики.
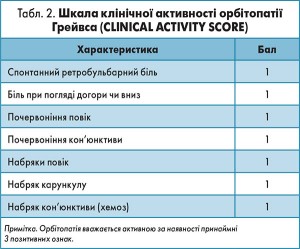
Вибір оптимального лікування залежить від активності та тяжкості процесу, які стандартизовані та легко оцінюються за відповідними шкалами (табл. 2, 3, 4), що не змінювалися з часів попереднього консенсусу.
2. Активність і тяжкість орбітопатії Грейвса мають визначатися за стандартизованими схемами та класифікуватися як активна/неактивна і легка/середньотяжка/дуже тяжка форма.
Усі випадки ОГ (окрім найлегших, які покращуються на тлі нормалізації тиреоїдного статусу і застосування топічних лубрикантів) мають направлятися до спеціалізованих центрів для обрання найкращої лікувальної тактики. За останніми популяційними дослідженнями до спеціалізованих центрів поступають пацієнти із менш тяжкою та менш активною ОГ, ніж раніше. Це свідчить про кращу обізнаність лікарів про це захворювання, проте більшість пацієнтів (56%) все одно незадоволені лікуванням, яке вони отримували з приводу своєї хвороби. Хоча ця цифра для спеціалізованих центрів Великої Британії сягає 67% порівняно із 52% для неспеціалізованих установ (p<0,05).
3. Усі пацієнти із орбітопатією, окрім найлегших форм, мають направлятися в центри ендокринної орбітопатії для комплексної оцінки офтальмологом і ендокринологом.
Взаємозв’язок ОГ і тютюнопаління давно доведений і вивчений у багатьох дослідженнях. Наразі підтверджені наступні факти: ОГ має більш тяжкий перебіг у курців; після лікування радіоактивним йодом виникнення чи прогресія орбітопатії частіше спостерігається у тих, хто палить; паління відстрочує і погіршує віддалені результати від імуносупресивної терапії; відмова від паління асоціювалася з кращим перебігом хвороби і меншими залишковими явищами.
4. Усі пацієнти з хворобою Грейвса (дифузним токсичним зобом), незалежно від наявності орбітопатії, мають відмовитися від паління.
Досягнення та стабільне підтримання еутиреозу має вирішальне значення за наявності ОГ, адже і гіпер-, і гіпотиреоз негативно впливають на прогресування орбітопатії. Антитиреоїдні препарати або тиреоїдектомія самі по собі не впливають на перебіг ОГ. Лікування радіоактивним йодом має невеликий, проте однозначно негативний вплив на розвиток і прогресування ОГ, особливо серед курців із тяжким тиреотоксикозом і високими рівнями антитіл до рецепторів тиреотропного гормона. Цьому можна запобігти профілактичним прийомом преднізолону у стартовій дозі 0,3-0,5 мг/кг на день курсом 3 місяці. Також в одному дослідженні було доведено ідентичну ефективність прийому менших доз меншим курсом (0,2 мг/кг курсом 6 тижнів).
А отже, пацієнтам із групи низького ризику можуть застосовуватися менші дози. За умови профілактичного прийому преднізолону під час лікування радіоактивним йодом всі 3 методи лікування тиреотоксикозу мають однакову ефективність і вплив на перебіг ОГ, а вибір методу залежить від індивідуальних обставин і вибору пацієнта.
5. В усіх пацієнтів із ОГ еутиреоз має досягатися швидко і підтримуватися стабільно.
6. Усім пацієнтам із групи ризику розвитку або прогресування ОГ, що проходять лікування радіоактивним йодом, має призначатися профілактичний курс преднізолону у дозі 0,3-0,5 мг/кг.
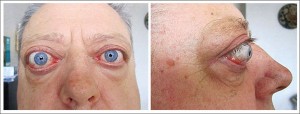
Синдром «сухого ока» є поширеним явищем серед пацієнтів із хворобою Грейвса навіть за відсутності клінічно вираженої орбітопатії. За наявності ОГ збільшена ширина очної щілини, екзофтальм, рідке кліпання, відставання повік, лагофтальм і порушений феномен Белла, а також зменшення секреції сльози спричиняють висихання поверхні ока.
Підвищення осмомолярності сльозної рідини є основною причиною розвитку синдрому «сухого ока» і значного погіршення якості життя пацієнтів. В усіх випадках базовою терапією є препарати штучної сльози без консервантів, такі як гіалуронат натрію, що мають застосовуватися декілька разів на день з ранніх етапів хвороби. Осмопротективні речовини забезпечують додатковий захист епітелію ока і полегшення симптоматики.
7. Усім пацієнтам з синдромом «сухого ока» мають призначатися топічні лубриканти – препарати штучної сльози з осмопротективними властивостями на весь період захворювання, які за необхідності доповнюються спеціальними гелями та мазями (особливо вночі).
Для більшості пацієнтів із орбітопатією легкої форми достатньо активного спостереження, що супроводжується контролем за факторами ризику прогресування хвороби та застосуванням локальних методів лікування. У деяких випадках вплив на якість життя стану пацієнта є настільки вираженим, що обумовлює призначення імуносупресивної терапії.
Ефект від лікування препаратами селену на перебіг легкої ОГ вивчався у великому мультицентровому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні. Пацієнтам вибірково призначався селен у дозі 200 мкг на добу (двічі на день) або плацебо. Первинними точками оцінювання були якість життя хворих та їх очні симптоми.
Через 6 місяців обидва показники значно покращилися у групі селену (61 проти 36% у групі плацебо, р<0,001), ця різниця спостерігалася впродовж наступних 6 місяців, коли пацієнти вже не приймали препарат. На додаток, прогресування ОГ до більш тяжких форм було значно нижчим у групі селену (7 проти 26% у групі плацебо, р<0,001).
Побічні явища не спостерігалися. Пацієнти, що брали участь у дослідженні, походять з регіонів із дуже низьким вмістом селену і поки що не зрозуміло, чи лікування буде настільки ж ефективним у недефіцитних регіонах. Для тривало існуючої, неактивної легкої ОГ нема підтвердження ефективності селену, тому у цій групі пацієнтів має застосовуватися реабілітаційна хірургія.
8. Для пацієнтів із орбітопатією легкої форми мають застосовуватися методи локальної терапії та міри контролю за факторами прогресування (тиреоїдна функція, паління). Якщо якість життя значно порушена (згідно з анкетою), то може застосовуватися імуносупресивна терапія для активних форм і реабілітаційна хірургія для неактивних форм.
9. Для пацієнтів із орбітопатією легкої форми має застосовуватися 6-місячний курс препаратів селену, адже доведена його ефективність щодо покращення очних симптомів і якості життя пацієнтів, а також попередження прогресування ОГ до більш тяжких форм.
Для пацієнтів із орбітопатією середньої тяжкості в активній фазі терапією першого ряду є внутрішньовенна високодозова глюкокортикоїдна терапія: 0,5 г метилпреднізолону 1 раз на тиждень 6 тижнів, а потім 6 тижнів по 0,25 г. Ця схема мала більшу ефективність порівняно із схемою, за якою ця ж сумарна доза вводилася за 4 тижні (77 проти 41% відповідно, р=0,0025). Згідно з іншими дослідженнями введення одноразово дози більше за 0,5 г або сумарної дози більше 8 г асоціюється із удвічі більшою частотою побічних ефектів (серцево-судинні, цереброваскулярні та гепатотоксичні). У свіжому огляді 14 досліджень, що включало 1045 пацієнтів із ОГ, захворюваність і смертність під час внутрішньовенної пульс-терапії метилпреднізолоном становила 6 і 0,6% відповідно. Рекомендовано проведення оцінки рівня печінкових ферментів, обстеження на вірусні гепатити, визначення рівня глюкози крові, а також ультразвукове дослідження печінки перед призначенням пульс-терапії. Пацієнтам зі «свіжим» вірусним гепатитом, вираженим порушенням печінкової функції, тяжкою серцево-судинною патологією та психічними захворюваннями, неадекватно контрольованою артеріальною гіпертензією або декомпенсованим цукровим діабетом таке лікування протипоказане. Печінкові ферменти, рівні глюкози та артеріального тиску мають моніторуватися принаймні щомісяця упродовж курсу лікування глюкокортикоїдами. Бажано застосовувати інгібітори протонної помпи для попередження виникнення пептичної виразки, а також профілактичні заходи щодо прогресування остеопорозу у групі ризику.
10. Для пацієнтів із орбітопатією середньої тяжкості в активній фазі терапією першого ряду є внутрішньовенна високодозова глюкокортикоїдна терапія, яка має проводитися у спеціалізованих установах, де можуть надати необхідну допомогу у разі виникнення побічних ефектів.
11. Сумарна доза інфузійних стероїдів не має перевищувати 8,0 грамів, а хворим з вірусним гепатитом, вираженим порушенням печінкової функції, тяжкою серцево-судинною патологією та психічними захворюваннями таке лікування протипоказане. Стан пацієнтів з цукровим діабетом і артеріальною гіпертензією має бути добре компенсованим перед початком лікування.
12. Для пацієнтів із орбітопатією середньої тяжкості в активній фазі оптимальним вважається лікування середніми дозами – 0,5 г метилпреднізолону щотижня 6 тижнів, а потім 6 тижнів по 0,25 г (сумарно 4,5 г). Для більш тяжких форм показані вищі дози – 0,75 г 6 тижнів, а потім 0,5 г 6 тижнів (сумарно 7,5 г).
13. Кожен пацієнт, що проходить пульс-терапію метилпреднізолоном, має прискіпливо оцінюватися спеціалістом щодо ефективності лікування та наявності побічних ефектів. У разі переважання негативних симптомів пульс-терапія може бути припинена, а лікування спрямоване на вибір іншого методу.
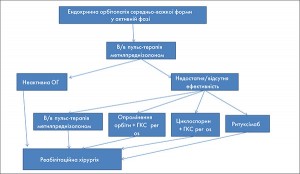
Терапія першого ряду призводить до покращення клінічної ситуації у більшості пацієнтів, проте у випадках її низької ефективності мають застосовуватися інші методи, доказова база яких, на жаль, є не такою однозначною. Ситуація ускладнюється, якщо хворі не налаштовані на повторний курс глюкокортикоїдів або перша терапія мала виражені побічні прояви.
14. Для пацієнтів із орбітопатією середньої тяжкості в активній фазі призначення терапії другого ряду має вирішуватися консиліумно.
Для пацієнтів з активною ОГ після першого курсу глюкокортикоїдів можливими є декілька шляхів:
А. Повторний курс пульс-терапії метилпреднізолоном, якщо пацієнт нормально її переносить, а сумарна доза не перевищить 8 г.
Б. Опромінення орбіти: радіотерапія показала високу ефективність щодо покращення двоїння і збільшення амплітуди рухів очних м’язів. У декількох рандомізованих дослідженнях радіотерапія показала таку ж ефективність як пероральні глюкокортикоїди, а їх комбінація покращувала віддалені результати.
Синергізм радіотерапії із внутрішньовенною пульс-терапією поки що недоведений остаточно. Основний режим опромінення триває 2 тижні і має сумарну дозу у 20 Гр на кожну орбіту, що фракціонується на 10 денних доз. Альтернативна схема, де використовується доза у 1 Гр 1 раз на тиждень, розтягнута на 20 тижнів, має таку ж ефективність, проте кращу переносимість. Після опромінення можливе помірне короткочасне погіршення очних проявів, яке можна контролювати профілактичним призначенням глюкокортикоїдів. Віддалені результати щодо безпечності цього методу лікування є вкрай позитивними.
В. Застосування циклоспорину наразі використовують у комбінації з пероральним преднізолоном, адже це значно покращує ефективність. Найбільш частими побічними ефектами є дозозалежна гепато- і нефротоксичність, а також гіперплазія ясен. Стартова доза зазвичай становить 5 мг/кг, а курс лікування триває до 12 місяців.
Г. Призначення ритуксимабу не затверджене його інструкцією для ОГ, проте він напряму впливає на B-клітини і моделює всї їх функції. Влив ритуксимабу вивчався у декількох дослідженнях, відкритих і рандомізованих.
Так, в одному з досліджень, де групою порівняння були пацієнти на внутрішньовенній пульс-терапії, інактивація процесу в орбіті відбулася в усіх пацієнтів (n=15) групи ритуксимаба (проти 69%), і реактивації хвороби не виникло у жодному з випадків після припинення лікування (31% у групі метилпреднізолону).
Ритуксимаб також виявився трішки ефективнішим у покращенні рухливості очних м’язів і покращенні якості життя пацієнтів. Початкова доза становила 1000 мг 1 раз на тиждень з повторною ін’єкцією через 2 тижні. Новіші дані говорять про ефективність одноразового введення 500 мг препарату (адже навіть доза 100 мг спричиняє майже повне зникнення B-клітин). В одному з опублікованих досліджень не вдалося показати вірогідних відмінностей між ритуксимабом і плацебо, більш того у 2 пацієнтів розвинулася нейропатія оптичного нерва. Основною відмінністю поміж дослідженнями був більш тривалий анамнез орбітопатії. Враховуючи такі суперечливі дані, необхідне проведення додаткових досліджень, щоб визначитися, чи може ритуксимаб стати препаратом першого ряду для лікування ОГ і конкурувати з пульс-терапією.
Поки що більшість публікацій свідчать про те, що цей препарат має застосовуватися після неефективного застосування пульс-терапії у хворих з нетривалим перебігом хвороби без значних ризиків виникнення дистиреоїдної нейропатії. Побічні ефекти виникають у 10-30% пацієнтів після першої інфузії і зазвичай швидко минають, а їх поява може бути мінімізована шляхом премедикації антигістамінними препаратами та інфузією 100 мг гідрокортизону перед основним лікуванням.
Д. Активне спостереження після відміни глюкокортикоїдів має бути запропоноване деяким хворим, бо порушення венозного відтоку із орбіти може симулювати підвищену активність орбітопатії (набряк повік, почервоніння кон’юнктиви, хемоз) у пацієнтів із довготривалим анамнезом захворювання. У таких випадках декомпресія орбіти значно полегшить ситуацію.
Е. Усі інші методи лікування можна віднести до методів третього ряду.
Так, у 2 рандомізованих клінічних дослідженнях було показано, що періокулярні ін’єкції тріамцінолон ацетату (40 мг/мл) зменшують диплопію і розмір очних м’язів у пацієнтів із активною і нетривалою ОГ, без серйозних локальних чи системних побічних ефектів. Субкон’юнктивальні ін’єкції тріамцінолон ацетату були ефективні у зменшенні набряку повік і незначному зменшенні ретракції у пацієнтів із «свіжою» орбітопатією. Єдиним побічним ефектом є транзиторне підвищення внутрішньоочного тиску.
Лікування іншими засобами (азатіоприн, ціамексон, аналоги соматостатину) не має достатньої доказової бази і наразі не може бути рекомендоване. Певну користь має введення ботулотоксину для лікування ретракції верхньої повіки та лагофтальму.
Пацієнти з орбітопатією середньої тяжкості у неактивній фазі будуть потребувати хірургічної реабілітації різних рівнів. Немає однозначних методик і вибір методу залежить від хірурга та індивідуальних особливостей пацієнта. Перевага віддається мінімально інвазивним методикам.
15. Реабілітаційна хірургія має бути запропонована пацієнтам із значними порушеннями зорових функцій або значно зниженою якістю життя, у яких хвороба знаходиться в неактивній фазі принаймні 6 місяців. Хірургічне втручання має проводитися виключно у спеціалізованих клініках досвідченими хірургами у зазначеному порядку: спочатку декомпресія орбіти, потім хірургічне втручання на очних м’язах, останнім етапом є операції на повіках.
16. Тяжкі ураження рогівки мають лікуватися медикаментозно або хірургічно якнайшвидше для уникнення прободіння рогівки.
17. У разі загрози ураження оптичного нерва негайно має призначатися внутрішньовенна терапія глюкокортикоїдами у великих дозах (500-1000 мг метилпреднізолону 3 дні поспіль або через день протягом першого тижня, за необхідністю), ургентна хірургічна декомпресія орбіти, якщо медикаментозна терапія недостатньо ефективна.
Виникнення хоріоїдальних складок або підвивих очного яблука є показанням для якнайшвидшої декомпресії орбіти. Якщо ситуація з дистиреоїдною нейропатією очного нерва покращилася, то необхідно продовжувати внутрішньовенну пульс-терапію метилпреднізолоном за схемою як для ОГ середньої тяжкості.
Останнім часом значні зрушення сталися у вивченні патогенезу та покращення методів діагностики та лікування ендокринної ОГ. Більша обізнаність лікарів призвела до зміни структури захворюваності на зазначену патологію – адже зменшилася кількість тяжких форм, а до третинних спеціалізованих центрів частіше потрапляють пацієнти з неактивною фазою захворювання. Це свідчить про вірний вибір лікувальної тактики на ранніх строках хвороби Грейвса і орбітопатії. На жаль, це не стосується нашої країни, де пацієнти з ОГ продовжують вірити, що хвороба минеться після хірургічного видалення щитоподібної залози, а все лікування зводиться до субкон’юнктивального введення дексаметазону. Опромінення орбіти і реабілітаційна хірургія щодо ОГ в Україні майже не практикуються.
В Українському науково-практичному центрі ендокринної хірургії МОЗ України створено центр допомоги хворим на ендокринну орбітопатію, планується проведення науково-практичної конференції, присвяченої цій проблемі. Сподіваємося на позитивні зміни щодо лікування хворих з ендокринною орбітопатією і в нашій країні.
Література
1. Bartalena L., Baldeschi L., Boboridis K. et al. The 2016 European Thyroid Association/European.
2. Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy // Eur J Endocrinol. – 2016. – Vol. 5. – P. 9-26.
3. Bartalena L., Baldeschi L., Dickinson A. et al. Consensus statement of the European Group on Graves’ orbitopathy (EUGOGO) on management of GO // Eur J Endocrinol. – 2008. – Vol. 158. – P. 273-285.
4. Capelli C., Gandossi E., Castellano M. et al. Prognostic value of thyrotropin receptor antibodies (TRAb) in Graves’ disease: a 120 months prospective study // Endocr J. – 2007. – Vol. 54, N.5. – P. 713-720.
5. Abraham P., Avenell A., Watson W.A. et al. Antithyroid drug regimen for treating Graves’ hyperthyroidism // Cochrane Database Syst Rev. – 2004. – Vol. 2. – CD003420.
6. Bartalena L., Bogazzi F., Tanda M.L. et al. Cigarette smoking and the thyroid // Eur J Endocrinol. – 1995. – Vol. 133. – P. 507-512.
7. Banga J.P., Nielsen C.H., Gilbert J.A. et al. Application of New Therapies in Graves’ Disease and Thyroid-Associated Ophthalmopathy: Animal Models and Translation to Human Clinical Trials // Thyroid. – 2008. – Vol. 18, N. 9. – P. 973-981.
8. Naik V., Khadavi N., Naik M.N. et al. Biologic Therapeutics in Thyroid-Associated Ophthalmopathy: Translating Disease Mechanism into Therapy // Thyroid. – 2008. – Vol. 18, N. 9. – P. 967-971.
9. Marino M., Morabito E., Brunetto M.R. et al. Acute and Severe Liver Damage Associated with Intravenous Glucocorticoid Pulse Therapy in Patients with Graves’ Ophthalmopathy // Thyroid. – 2004. – Vol. 14, N. 5. – P. 403-406.
10. Marcocci C., Bartalena L., Tanda M.L. et al. Comparison of the effectiveness and tolerability of intravenous or oral glucocorticoids associated with orbital radiotherapy in the management of severe Graves’ ophthalmopathy: Results of a prospective, single-blind, randomized study // J Clin Endoc Metab. – 2001. – Vol. 86. – P. 3562-3567.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
Нещодавні дослідження показали, що прогноз за різних поширених захворювань, ендокринних, автоімунних розладів і навіть прогресування раку пов’язані з концентрацією вітаміну D у плазмі. Завдяки експресії гена 1α-гідроксилази (CYP27B1) клітини імунної системи (В-, Т- та антигенпрезентувальні клітини) здатні продукувати активний метаболіт кальциферол – речовину з імуномодулювальними властивостями. Рецептори до вітаміну D (vitamin D receptor, VDR) експресують на поверхні імунних клітин. Доведено зв’язок між поліморфізмом генів VDR або CYP27B1 і патогенезом автоімунних ендокринних захворювань. Метою огляду є вивчення впливу вітаміну D, наслідків його дефіциту та корисної ролі добавок із ним при деяких ендокринних розладах, які часто спостерігають у клінічній практиці. ...
Збудник COVID‑19, SARS-CoV‑2, з яким людство вперше стикнулося у 2019 р., поширився по всьому світу, заразивши мільйони людей. Сьогодні, через тягар війни та економічної нестабільності, тема COVID‑19 не сприймається так гостро, як ще кілька років тому, хоча насправді вона не втратила своєї актуальності. Саме сучасному стану проблеми COVID‑19 у світі та в Україні була присвячена доповідь директора ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», академіка Національної академії медичних наук України, члена-кореспондента НАН України, віце-президента НАМН України, президента Асоціації ендокринологів України, професора Миколи Дмитровича Тронька під час першого у 2024 р. засідання науково-освітнього проєкту «Школа ендокринолога», яке відбулося 20-24 лютого. ...
Протягом останніх 60 років метформін є найпоширенішим цукрознижувальним засобом і рекомендований як препарат першої лінії для осіб з уперше виявленим цукровим діабетом (ЦД) 2 типу. Сьогодні понад 200 млн осіб із ЦД 2 типу в усьому світі щодня застосовують метформін як монотерапію або в комбінації. Препарат усе частіше використовують для лікування гестаційного ЦД та в пацієнтів із синдромом полікістозних яєчників. ...
Двадцять восьмого лютого 2024 року виповнилося 80 років від дня народження директора ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (далі – Інститут), віцепрезидента НАМН України, академіка НАМН України, члена-кореспондента НАН України, заслуженого діяча науки та техніки, лауреата Державної премії України, доктора медичних наук, професора Миколи Дмитровича Тронька....